
C. 反应中共消耗Zn
4.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3=Cu(NO3)2+NO↑+NO2↑+H2O。
(1) 硝酸在该反应中的作用是 ,该反应的还原产物是 。
3.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A
A. 气体A为SO2和H2的混合物 B. 气体A中SO2与H2的体积比为4:1
1.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平)),则在上述反应中,羟胺的氧化产物是
(A)N2 (B)N2O (C)NO (D)NO2
2.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1:1
B.
C.
D.2mol SO 2和1mo lO 2 混合在V2 O 5存在的条件下密闭容器中加热反应后,容器内物质分子数大于2 NA
² 氧化还原反应(包括氧化还原反应基本概念;氧化性还原性强弱的判断;根据得失电子守恒推断氧化产物或还原产物;配平氧化还原反应的方程式并标出电子转移的方向和数目)
A.
(D)标准状况下,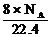
4.设NA为阿伏加德罗常数值,下列叙述中不正确的是
(B)1mol冰醋酸中含有6.02×1023个CH3COO―
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就得到1mol电子
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体
(C)
(D)1molC10H22分子中共价键总数为31NA
3.下列有关阿伏加德罗常数的叙述正确的是
4.镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为
A.镓是制造高温温度计的上佳材料 B. 镓能溶于强酸和强碱中
C.镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中
D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”,这是利用了镓的导电性介于导体和绝缘体之间的性质
² 有关阿伏加德罗常数的判断和计算
1.设NA代表阿佛加德罗常数,下列说法错误的是
A.
C.
D.
2.NA代表阿伏加德罗常数值,下列说法正确的是
(A)
(B)1molMgCl2中含有离子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com