
6.锌钡白(BaSO4和ZnS的混合物)在油漆、橡胶、造纸、陶瓷等工业中有广泛用途,ZnS是难溶于水的白色化合物。某化工厂用重晶石为原料制备锌钡白,反应过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸汽等),为防止空气污染并提高原料利用率,生产采用下述工艺流程:
5.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+ 34%~36% ,是薄衣片,……,与VC(维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分进行了验证。请一起完成该实验:
第一步:查阅资料得知,双氧水可以氧化SCN- 生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有 离子存在(填离子符号);
第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就是以三价铁的形式存在; ②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成。
第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示):
溶液红色又褪去的原因可能是:
请自选中学实验室中常用仪器、药品,设计实验证明你的推测:
;
第六步:向B试管的溶液中加入一片VC片,片刻后溶液红色也褪去,说明VC有 性;怎样理解药品说明中所述“与VC同服可增加本品吸收”这句话?
4.已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;② 取①中溶液少量,加入NaOH溶液,无明显现象发生;③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
【提示】Ⅰ.注意文字简洁,不超过答题卡空间;Ⅱ.④⑤可填满也可不填满,不够可增加。
编号
实验操作
预期现象和结论
④
⑤
3.进行化学实验必须注意安全,下列几种处理事故的方法正确的是
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干 ②苯酚酒到皮肤上,用Na2CO3溶液洗涤 ③酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭
④误食重金属离子,喝煮沸过的鲜牛奶 ⑤镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 ⑥实验时不慎被玻璃划破手指,引起轻微流血时,用三氯化铁溶液涂抹止血
A.全部正确 B,只有②③④⑤正确 C.只有⑥正确 D.全部错误
2.下列各组中的实验不能达到预期目的的是
A.用浓硫酸与溴化钠强热制溴化气气体B.用盐酸酸化的硝酸钡检验亚硫酸钠是否被氧化
C.用新制氢氧化铜鉴别葡萄糖、甲醛和甲酸溶液 D.用溴水鉴别苯、苯酚和苯乙烯
1.下列实验指定使用的仪器必须预先干燥的是
①中和热测定中所用的小烧杯 ②中和滴定中所用的锥形瓶 ③ 配置一定物质的量浓度溶液中所用的容量瓶 ④喷泉实验中用于收集NH3的烧瓶
A.①② B.①④ C.②③ D.③④
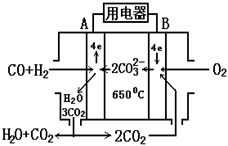 请回答下列问题:
请回答下列问题:
(1)B极为 极,发生 (填“氧化”或“还原”)反应,该极发生的电极反应为 ;
(2)电池总反应为___________________ _________。
|