
40.下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
[答案] D (06全国Ⅰ)
39.下列分子中,所有原子不可能共处在同一平面上的是
A. C2H2
B. CS
[答案] C (04湖川吉)
38.下列反应完成后没有沉淀的是
A. BaCl2溶液与Na2CO3溶液加足量稀CH3COOH B. Ba(OH)2溶液与KNO3溶液加足量稀H2SO4
C. AgNO3溶液与Na2CO3溶液加足量稀HCl D. Ca(OH)2溶液与FeCl3溶液加足量稀HNO3
[答案] D (04广东化学)
37.下列关于浓硫酸的叙述正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化碳气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
[答案] D (04江苏)
D. 外电路中每通过0.2 mol电子,锌的质量理论上减小6.
[答案] C (04江苏化学)
36.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌―锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C. 电池工作时,电子由正极通过外电路流向负极
35.甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol / L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10 mol / L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知
A、a的浓度必小于乙酸的浓度 B、a的浓度必大于乙酸的浓度
C、b的浓度必小于乙酸的浓度 D、b的浓度必大于乙酸的浓度
[答案] A (04广东化学)
34.将0.1 mol / L的醋酸溶液加水稀释,下列说法正确的是
A. 溶液中c(H+)和c(OH-)都减少 B. 溶液中c(H+)增加
C. 醋酸电离平衡向左移动 D. 溶液的pH增大
[答案] C (04湖川吉)
33.某温度下在密闭容器中发生如下反应: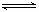
2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为 A.20% B.40% C.60% D.80%
[答案] C (2004理综)
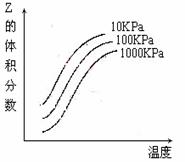 A.上述可逆反应的正反应为放热反应
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
[答案] C (05全国卷I)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com