
[答案](1)6.0 (2)C;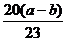 (3)
(3)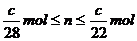 (04北京)
(04北京)
(1)甲取样品①强热,叵所得固体为金属铜,将其置于足量的稀硝酸中微热,产生
(2)乙取样品② a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 。样品②中氧化铜质量为 g(以含a、b的代数式表示)
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 。
36.有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
C的相对分子质量=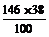 =56或=
=56或=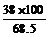 =56)
=56)
由此推断C的化学式是CaO (00广东)
(3) CaC2O4 CaCO3 +CO (4)由图读得分解产物C的质量约为38 mg
CaCO3 +CO (4)由图读得分解产物C的质量约为38 mg
[答案] (1)CaC2O4 CaCO3 (2)CaC2O4?H2O CaC2O4十H2O
CaC2O4十H2O
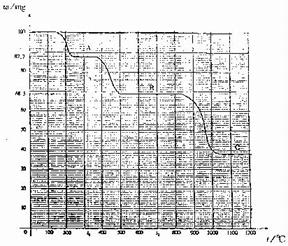 35.下图是100 mg
CaC2O4?H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
35.下图是100 mg
CaC2O4?H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
(1)温度分别为t1和t2时,固体产物的化学式A是: ,B是: 。
(2)由CaC2O4?H2O得到A的化学方程式为 。
(3)由A得到B的化学方程式为 。
(4) 由图计算产物C的相对分子质量,并推断C的合理的化学式。
(4)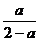
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。 (03江苏)
若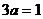 ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若
A(气)+B(气)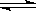 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为
mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
[答案](1)(1-a) (2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com