
8. 只用下列正多边形地砖中的一种,能够铺满地面的是( )
 (A)正十边形 (B)正八边形
(A)正十边形 (B)正八边形
(C)正六边形 (D)正五边形
7.
下列函数中,自变量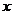 的取值范围是
的取值范围是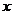 ≥3的是( )
≥3的是( )
(A)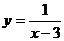 (B)
(B)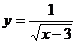
(C)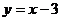 (D)
(D)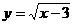
6. 下列运算正确的是( )
(A)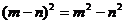 (B)
(B)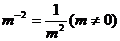
(C)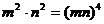 (D)
(D)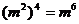
5.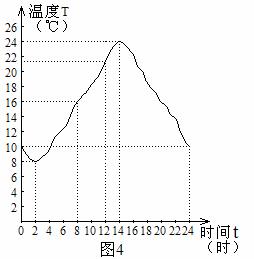 图4是广州市某一天内的气温变化图,根据图4,下列说法中错误的是( )
图4是广州市某一天内的气温变化图,根据图4,下列说法中错误的是( )
(A)这一天中最高气温是24℃
(B)这一天中最高气温与最低气温的差为16℃
(C)这一天中2时至14时之间的气温在逐渐升高
(D)这一天中只有14时至24时之间的气温在逐渐降低
4.
二次函数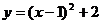 的最小值是( )
的最小值是( )
(A)2 (B)1 (C)-1 (D)-2
3.
实数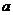 、
、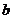 在数轴上的位置如图3所示,则
在数轴上的位置如图3所示,则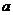 与
与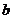 的大小关系是( )
的大小关系是( )
(A)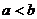 (B)
(B)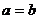
(C)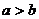 (D)无法确定
(D)无法确定
2. 如图2,AB∥CD,直线
如图2,AB∥CD,直线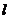 分别与AB、CD相交,若∠1=130°,则∠2=( )
分别与AB、CD相交,若∠1=130°,则∠2=( )
(A)40° (B)50° (C)130° (D)140°
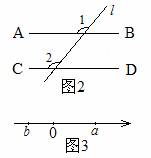
1. 将图1所示的图案通过平移后可以得到的图案是( )
18.(09宁夏卷 37)[化学-选修化学与技术](15分)
37)[化学-选修化学与技术](15分)
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①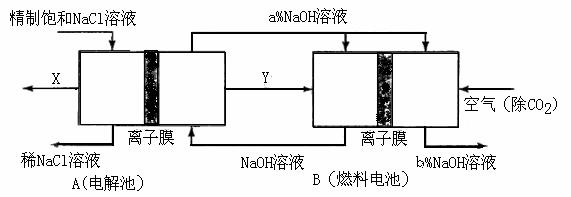 图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
 答案:(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2)③①②
答案:(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2)③①②
(3)①Cl2 H2 a%小于b% ②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O ③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)


 解析:(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;
解析:(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;
(2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;
(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2 ;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X,必然为Cl2了;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH- 可知NaOH+浓度增大。
17.(09海南卷 15)(9分)
15)(9分) Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =
4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =
4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
答案: (1)锂
(1)锂
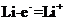 (2分)
(2分)
 (2)
(2)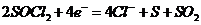 (2分)
(2分)
 (3)出现白雾,有刺激性气体生成
(3)出现白雾,有刺激性气体生成 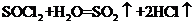 (3分)
(3分)
 (4)锂是活泼金属,易与
(4)锂是活泼金属,易与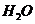 、
、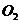 反应;
反应;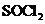 也可与水反应(2分)
也可与水反应(2分)
解析:根据原电池中负极发生氧化反应,失电子可得到(1)答案,再依据正极负极方程式叠加可得到总方程式,因此(2)也就可以写出了.(3)只要利用水解的相关知识就可以写出该方程式。
点评:本题主要考查原电池和水解的相关知识.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com