
4、物理意义:描述物体速度变化的快慢的物理量
举例:一架飞机在地面从静止加速到刚离开地面的过程中,约在30内速度增加到约300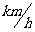
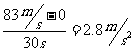 (相当于83 m/s),飞机的速度的变化与发生这个变化所用时间之比
(相当于83 m/s),飞机的速度的变化与发生这个变化所用时间之比
一门迫击炮射击时,炮弹在炮筒中的速度在0.005s内就可以由0增加到250 m/s,炮弹的速度的变化与发生这个变化所用时间之比
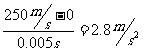
炮弹的速度变化,比飞机起飞速度的变化快的多。
让学生观察表中的数据,判断以下问题的对错
(1) 速度大,物体的加速度大
(2) 速度变化量大,物体的加速度大
总结:加速度是速度变化率,只表示速度的变化快慢,不表示速度变化的大小
例1做加速运动的火车,在40s内速度从36 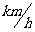 增加到72
增加到72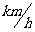 ,求火车加速度的大小。
,求火车加速度的大小。
解:由于初速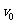 =36
=36
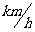 =10m/s 末速v=72
=10m/s 末速v=72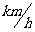 =20 m/s
=20 m/s 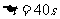
速度的变化量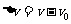 =20
m/s -10 m/s=10 m/s
=20
m/s -10 m/s=10 m/s
所以火车的加速度a=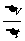 =
= 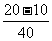
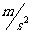 =0.25
=0.25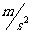
例2汽车紧急刹车时做减速运动,在2内速度从36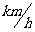
 减小到0,求汽车的加速度。
减小到0,求汽车的加速度。
解:由于初速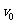 =36
=36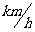 =10m/s 末速
=10m/s 末速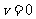 m/s
m/s  =2s
=2s
速度的变化量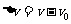 =0
m/s -10 m/s=-10 m/s
=0
m/s -10 m/s=-10 m/s
所以汽车的加速度a=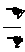 =
=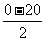
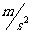 =
=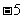
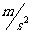
讨论:1、0.25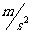 的意义和
的意义和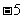
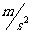 的意义:2、比较速度0.25
的意义:2、比较速度0.25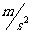 和
和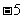
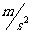 的大小
的大小
20.(10分)下图是利用石油为原料合成增塑剂G的基本流程:
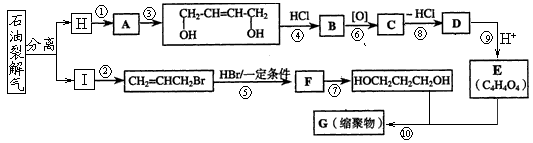
请完成下列各题:
(1)分别写出反应④⑩的反应类型,④是 、⑩是 ,反应⑧的条件是 ;
(2)写出反应⑦的化学方程式: ;
(3)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 ;
(4)写出E所含官能团的名称 ,写出G 的结构简式 。
19.(12分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-、NO3- 、I-,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论(确定或排除的离子)与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
18.(13分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
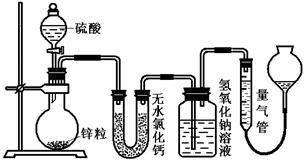 (1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 ;
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 ;
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为: ;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有: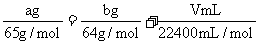 ,依据的原理是
;
,依据的原理是
;
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,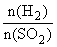 =
(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=
(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,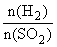 的数值将 (填偏大、偏小或无影响);
的数值将 (填偏大、偏小或无影响);
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①
②
③ 。
17.(17分)X、Y、Z、L、M、Q六种元素的原子序数依次增大。X、Y、Z、L是组成氨基酸的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L元素原子的电子式是 ;M在元素周期表中的位置为 ;前五种元素的原子半径从大到小的顺序是 (用元素符号表示);Y、Z、L三种元素的最简单氢化物中属于极性分子的有 ,属于非极性分子的有 (填化学式);
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子构型为 ,B的结构式为 ;
(3)Q是人体必需的微量元素,与L同一主族,Q原子比L原子多两个电子层,则Q的原子结构示意图为 ,其最高价氧化物对应的水化物化学式为 ;该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol H2Q反应热的是__________(填字母代号);
A.+99.7 kJ· mol·L-1 B.+29.7 kJ·mol·L-1
C.-20.6 kJ·mol·L-1 D.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Z。写出阳极生成R的电极反应式: ;由R生成Z的化学方程式: 。
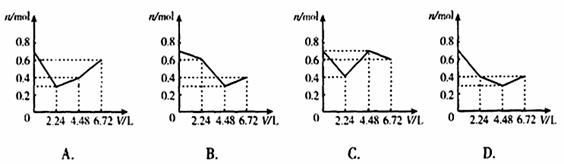
16.往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)
第Ⅱ卷 非选择题(共52分)
15.200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为
A.5.8 B.11.6 C.23.2 D.46.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com