
7.某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g·cm-3。RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷bmL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀。
④将沉淀过滤、洗涤、干燥后称重,得到固体c g 。
回答下列问题:
(1)装置中长玻璃管的作用是 。
(2)步骤④中洗涤的目的是为了除去沉淀吸附的 离子。
(3)该卤代烷中所含卤素的名称是 ,判断依据是 。
(4)该卤代烷的相对分子质量是 (列出算式)。
(5)如果在步骤②中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值 (填下列选项代码)。
A.偏大 B.偏小 C.不变 D.大小不定
6.溴乙烷与NaOH水溶液反应,主要产物是 ,化学反应方程式是 ;该反应属于 反应。
溴乙烷与NaOH乙醇溶液共热,主要产物是 ,化学反应方程式是 ;该反应属于 反应。
5.欲得到较纯一氯代烃的方法是 ( )
A.乙烷与Cl2发生取代反应 B.乙烯与Cl2发生加成反应
C.乙烯与HCl发生加成反应 D.乙炔与HCl发生加成反应
4.有关溴乙烷的以下叙述中正确的是 ( )
A.溴乙烷不溶于水,溶于有机溶剂
B.在溴乙烷中滴入硝酸银,立即析出浅黄色沉淀
C.溴乙烷跟KOH的醇溶液反应生成乙醇
D.溴乙烷通常是由溴跟乙烷直接反应来制取的
3.能直接与硝酸银溶液作用产生沉淀的物质是 ( )
A.氢溴酸 B.氯苯 C.溴乙烷 D.四氯化碳
2.下列物质中不属于卤代烃的是 ( )
A.C6H5Cl B.CH2=CHCl C.CH3COCl D.CH2Br2
1.下列关于氟氯烃的说法中,不正确的是 ( )
A.氟氯烃是一类含氟和氯得卤代烃
B.氟氯烃化学性质稳定,有毒
C.氟氯烃大多数无色,无臭,无毒
D.在平流层,氟氯烃在紫外线照射下,分解产生氯原子可引发损耗O3的循环反应
2、溶液的pH:
(1)定义:pH =-lg{c(H+)}
(2)适应范围:稀溶液,0-14之间。
有关溶液的pH值的几个注意问题:
①pH值是溶液酸碱性的量度。常温下,pH=7溶液呈中性;pH值减小,溶液的酸性增强;pH值增大,溶液的碱性增强。
②pH值范围在0-14之间。pH=0的溶液并非没有H+,而是C(H+)=1mol/L;pH=14的溶液并非没有OH-,而是C(OH-)=1mol/L。pH改变一个单位,C(H+)就改变10倍,即pH每增大一个单位,C(H+)就减小到原来的1/10;pH每减小一个单位,C(H+)就增大到原来的10倍。
③当C(H+)>1mol/L时,pH值为负数,当C(OH-)>1mol/L时,pH>14。对于C(H+)或C(OH-)大于1mol/L的溶液,用pH值表示反而不方便,所以pH值仅适用于C(H+)或C(OH‑)小于等于1mol/L的稀溶液。
④也可用pOH来表示溶液的酸碱性,pOH=-lgC(OH--),因为C(H+)·C(OH-)=10-14,若两边均取负对数,得pH+pOH=14。
⑤可用 pH试纸来测定溶液的pH值。方法:用洁净的干玻璃棒直接蘸取少许待测液,滴在pH试纸上(注意不能将pH试纸先用水沾湿或用湿的玻璃棒,因为这样做,实际上已将溶液稀释,导致所测定的pH不准确)将pH试纸显示的颜色随即(半分钟内)与标准比色卡对照,确定溶液的pH值(因为时间长了,试纸所显示的颜色会改变,致使测得的pH不准。)
1、 溶液的酸碱性与c(H+)和c(OH-)的关系:
投影显示空表,教师引导填写,然后推出结论。
|
电解质 溶液 |
对水电离平衡的影响 |
溶 液 中 c(H+) (mol/L) |
溶 液 中c(OH-)(mol/L) |
c(H+)与 c(OH-)比较 |
c(H+)· c(OH-) |
溶液酸碱性 |
|
纯水 |
|
=10-7 |
=10-7 |
相 等 |
10-14 |
中性 |
|
盐酸 |
加HCl,c(H+)增大,平衡左移 |
>10-7 |
<10-7 |
c(H+)> c(OH-) |
10-14 |
酸性 |
|
氢氧化钠 |
加NaOH,c(OH-)增大,平衡左移 |
<10-7 |
>10-7 |
c(H+)< c(OH-) |
10-14 |
碱性 |
中性溶液c(H+)= c(OH-)= 1×10-7mol/L
酸性溶液c(H+)> c(OH-),c(H+)> 1×10-7mol/L
碱性溶液c(H+)< c(OH-),c(H+)< 1×10-7mol/L
注:①水中加酸或碱均 抑 制水的电离,但由水电离出的c(H+)与c(OH-)总是相等。
②任何电解质溶液中,H+与OH-总是共存,但不能大量共存。溶液的酸、碱性主要在于c(H+)与c(OH-)的相对大小。c(H+)与c(OH-)此增彼长,且Kw = c(H+)·c(OH-)不变。
讲述:酸性溶液中c(H+)越大,酸性越强,碱性溶液中c(OH-)越大,碱性越强。我们经常用到一些c(H+)很小的溶液,如c(H+)=1×10-7 mol/L的溶液,用这样的量来表示溶液的酸碱性的强弱很不方便。为此,化学上常采用pH来表示溶液酸碱性的强弱。
1、水的电离
H2O + H2O 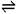 H3O+ + OH- 简写为:H2O
H3O+ + OH- 简写为:H2O 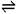 H+ + OH-
H+ + OH-
实验测定:25℃ [H+]=[OH-]=1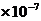 mol/L 100℃ [H+]
= [OH-] = 1
mol/L 100℃ [H+]
= [OH-] = 1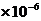 mol/L
mol/L
水的电离与其它弱电解质的电离有何异同?
不同点:水是“自身”作用下发生的极微弱的电离。
相同点:均是部分电离,存在电离平衡
提问:请学生计算水的浓度,1L纯水的物质的量是55·6mol,经实验测得250C时,发生电离的水只有1×10-7mol,二者相比,水的电离部分太小,可以忽略不计。因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新的常数,用Kw表示,即为水的离子积常数,简称水的离子积。
板书2、水的离子积
Kw = c(H+)·c(OH-)
由于250C时,c(H+)= c(OH-)= 1×10-7mol/L
所以250C时,Kw = c(H+)·c(OH-)=1×10-14(定值)(省去单位)
提问:当温度升高时,Kw如何变化?影响Kw的因素是什么?(电离过程是吸热过程)
1000C时,Kw = c(H+)·c(OH-)=1×10-12
影响因素:温度越高,Kw越大,水的电离度越大。对于中性水,尽管Kw,电离度增大,但仍是中性水,[H+]=[OH-].
注:温度升高时Kw增大,所以说Kw时要强调温度。
练习:
|
影响因素 |
条件改变 |
平衡移动 |
溶液中的c(H+) |
溶液中的c(OH-) |
Kw |
|
温度 |
升高温度 |
向右 |
增大 |
增大 |
变大 |
|
降低温度 |
向左 |
减小 |
减小 |
变小 |
|
|
酸碱性 |
加入酸 |
向左 |
增大 |
减小 |
不变 |
|
加入碱 |
向左 |
减小 |
增大 |
不变 |
过渡:在常温时,由于水的电离平衡的存在,不仅是纯水,就是在酸性或碱性的稀溶液里,H+ 浓度和OH-浓度的乘积总是一个常数--1×10-14,请考虑一下,当纯水中加入盐酸或氢氧化钠时,c(H+)和c(OH-)如何变化?
板书:二、溶液的酸碱性和pH(常温下):
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com