
1、基本计算方法
(1) 代数方程组法------解决混合物问题的基本方法
[投影]例1 将70克由Na2O2和Na2O组成的混合物跟98克H2O充分反应后,所得NaOH溶液中溶质的质量分数为50%,试分别写出Na2O2和Na2O 跟H2O 反应的化学方程式,并计算原混合物中Na2O2和Na2O的质量。
解:设混合物中有Na2O2 的物质的量为x mol,Na2O的物质的量为y mol
2Na2O2+2H2O==4NaOH+O2 ↑
2 4 1
x 2x 0.5x
Na2O + H2O === 2NaOH
y y 2y
由题意可得,78x+62y=70 
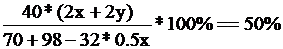
解得,x= 0.5 mol y=0.5 mol
则混合物中Na2O2 的质量为39克,Na2O的质量为31克。
[点击试题]1、今有Na2CO3与NaHCO3混合物1.37克,加热到不再产生气体为止,残余物与足量盐酸反应后,得到CO2气体0.44克,求原混合物中Na2CO3的质量分数为多少?
[板书]2、差量法
[讲]差量法是依据化学变化前后物质的量的变化,找出所谓“理论差量”,再根据题目提供的“实际差量”列出比例式,求出答案。
[板书]数学原理: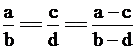
[投影]例2 将一定量H2和CuO 10克共热,CuO部分被还原,得到固体粉末质量为8.4克,有多少克Cu生成?参加反应的H2有多少克?
解: CuO + H2  Cu + H2O
△m
Cu + H2O
△m
80 2 64 80-64==16
y x 10-8.4=1.6 g
解得 x=6.4g y=0.2g
[投影]例3 加热10克Na2CO3和NaHCO3混合物至质量不再变化,剩余的固体质量为8.4克,求混合物中Na2CO3的质量分数是多少。
解: 2 NaHCO3  Na2CO3 + H2O↑ +CO2↑ △m
Na2CO3 + H2O↑ +CO2↑ △m
84*2 106 84*2-106=62
x 10-8.4=1.6 g
x==4.34 g
w(Na2CO3)%==56.6%
[点击试题]1、将CO2气体通过78克Na2O2固体,一段时间后测得固体质量增至92克,求生成O2的质量
1、滴加顺序不同,实验现象不同
[投影总结]
(1)稀Na2CO3溶液与稀盐酸间的反应
向Na2CO3溶液中逐滴加入稀盐酸,开始时无气体产生,达到一定量后才有气泡冒出,由少到多的过程中依次发生下列反应:
Na2CO3+HCl==NaCl+NaHCO3
NaHCO3+HCl==NaCl+CO2 ↑+H2O
向稀盐酸中逐滴加入稀Na2CO3溶液立即有气泡冒出,由少到多只发生下列反应:
2HCl+Na2CO3==2NaCl+CO2 ↑+H2O
(2) 稀AlCl3溶液与稀NaOH溶液间的反应
向AlCl3溶液中滴加NaOH溶液直至过量时发生的反应依次为:
Al3+ +3OH―==Al(OH)3 ↓ Al(OH)3+OH―==AlO2―+2H2O
现象:白色沉淀逐渐增多,继续加NaOH溶液沉淀逐渐溶解,直至完全消失。
向NaOH 溶液中滴加AlCl3溶液至过量时发生的反应依次为:
Al3++4OH―==AlO2―+2H2O Al3++3AlO2―+6H2O ==4Al(OH)3 ↓
现象:开始时无沉淀,接着产生沉淀,继续滴加AlCl3溶液,沉淀量不变。
(3) 稀NaAlO2溶液与稀盐酸间的反应:
向盐酸溶液中滴加NaAlO2溶液,直至过量时发生的反应依次为:
4H+ +AlO2―==Al3++2H2O Al3++3AlO2―+6H2O ==4Al(OH)3↓
现象:开始无沉淀,接着产生白色沉淀,逐渐增多至达到最大值,继续加入NaAlO2溶液,沉淀量不变。
向NaAlO2溶液中滴加盐酸直至过量时发生的反应依次为:
AlO2―+H+ +H2O==Al(OH)3↓ Al(OH)3+3H+==Al3++3H2O
现象:白色沉淀逐渐增多至最大值,继续加盐酸,沉淀逐渐减少,最后完全消失。
[板书]三、本章专题讲座――-有关金属及其化合物的有关计算
1、铁的氧化物
[投影总结]
|
|
FeO |
Fe2O3 |
Fe3O4 |
|
颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
|
俗名 |
--- |
铁红 |
磁性氧化铁 |
|
水溶性 |
不溶 |
不溶 |
不溶 |
|
稳定性 |
不稳定,在空气里加热迅速被氧化, |
稳定 |
稳定 |
|
氧化物类别 |
碱性氧化物 |
碱性氧化物 |
复杂氧化物 |
|
与非氧化性酸反应 |
FeO+2HCl==FeCl2+H2O
(FeO+2H+==Fe2++H2O) |
Fe2O3+6HCl==2FeCl3 +3H2O
(Fe2O3+6H+==2Fe3+ +3H2O ) |
Fe3O4+8HCl==2FeCl3+FeCl2+4H2O
Fe3O4+8H+==2Fe3++Fe2++4H2O |
[板书]2、铁的氢氧化物及Fe2+ 与Fe3+的转化
[投影总结]
|
|
二价铁 |
三价铁 |
|
化 学 式 |
FeCl2 |
FeCl3 |
|
名 称 |
氯化亚铁 |
氯化铁 |
|
溶液颜色 |
浅绿色 |
黄色 |
|
与氢氧化钠 |
现象:产生白色沉淀,迅速变成灰绿色,最后变成红褐色。FeCl2+2NaOH
==Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O ==4Fe(OH)3 |
现象:产生红褐色沉淀 FeCl3+3NaOH ==Fe(OH)3 ↓+ 3NaCl |
|
与KSCN溶液 |
无现象 |
产生血红色 Fe3++3SCN-==Fe(SCN)3 |
|
氧化(还原性) |
主要表现:
还原 性,举例: 2FeCl2+Cl2 ==2FeCl3 |
表现:氧化性,举例: 2FeCl3+Fe==3FeCl2 |
|
相互转化 |
 FeCl2
FeCl3: FeCl2
FeCl3:2FeCl2+Cl2 ==2FeCl3 |
 FeCl3
FeCl2: FeCl3
FeCl2:2FeCl3+Fe==3FeCl2 |
|
名 称 |
氢氧化亚铁 |
氢氧化铁 |
|
化学式 |
Fe(OH)2 |
Fe(OH)3 |
|
颜色、状态 |
白色固体 |
红褐色固体 |
|
水溶性 |
难溶于水 |
难溶于水 |
|
与酸反应 |
Fe(OH)2+2HCl==FeCl2+2H2O Fe(OH)2+2H+==Fe2++2H2O |
Fe(OH)3+3HCl==FeCl3+3H2O Fe(OH)3+3H+==Fe3++3H2O |
|
氢氧化亚铁露置空气中 |
4Fe(OH)2+O2+2H2O ==4Fe(OH)3 |
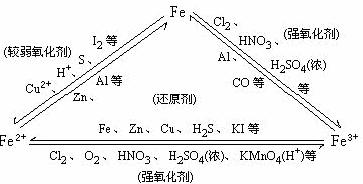
[板书]3、铁三角
[投影总结]
[板书]二、本章典型题剖析
1、钠的性质
[投影总结]
(1)钠的物理性质:银白色、质软、比水轻、熔点低
(2)钠的化学性质:
与非金属反应:2Na+Cl2 2NaCl (白烟)
2NaCl (白烟)
2Na+S==Na2S
与O2反应:缓慢氧化:4Na+O2== 2Na2O (白色固体)
剧烈燃烧:2Na+O2== Na2O2 (淡黄色固体)
与H2O 反应:2Na+2H2O==2NaOH+H2↑
(2Na+2H2O==2Na++2OH―+H2↑)
与酸反应:2Na+2H+==2Na++H2↑
与盐溶液反应:(先与水作用生成NaOH,NaOH再与盐发生复分解反应)
2Na+2H2O+CuSO4 ==Cu(OH)2↓+Na2SO4 +H2↑
6Na+6H2O+2FeCl3==2Fe(OH)3↓+6NaCl+3H2↑
2Na+2NH4Cl===2NaCl+2NH3↑+H2↑
与熔融盐:4Na+TiCl4  4NaCl+Ti
4NaCl+Ti
[板书]2、钠的氧化物
|
|
氧化钠 |
过氧化钠 |
|
|
化学式 |
Na2O |
Na2O2
|
|
|
化合价 |
O(-2) |
O(-1) |
|
|
颜色、状态 |
白色固体 |
淡黄色粉末 |
|
|
化学性质 |
O2 |
2Na2O+O2
==Na2O2 |
--- |
|
CO2 |
Na2O+CO2==Na2CO3 |
2Na2O2+2CO2==2Na2CO3+O2 ↑ |
|
|
H2O |
Na2O+H2O==2NaOH |
2Na2O2+2H2O==4NaOH+O2 ↑ |
|
|
HCl |
Na2O+2HCl==2NaCl+H2O |
2Na2O2+4HCl==4NaCl+2H2O+O2↑ |
|
|
SO2 |
Na2O+SO2==Na2SO3
|
Na2O2 +SO2 ==Na2SO4
|
|
|
类别 |
碱性氧化物 |
过氧化物 |
[投影总结]
[板书]3、碱------氢氧化钠
[讲]NaOH,白色固体,易潮解,俗名苛性钠,烧碱,火碱。一元强碱,具有碱的通性,即:
能与酸反应生成盐和水,例:NaOH+HCl==NaCl+H2O
能与酸性氧化物反应生成盐和水,例:2NaOH+CO2==Na2CO3+H2O
能与某些盐发生复分解反应,例:2NaOH+CuCl2==Cu(OH)2↓+2NaCl
[板书]4、盐------碳酸钠和碳酸氢钠
[投影总结]
|
物质 |
Na2CO3 |
NaHCO3 |
|
俗名 |
苏打、纯碱 |
小苏打 |
|
颜色、状态 |
白色固体 |
白色粉末 |
|
水溶性 |
易溶于水 |
能溶于水 |
|
溶解度大小比较: Na2CO3 >NaHCO3 |
||
|
溶液与酚酞 |
变红 |
变红 |
|
颜色深浅比较: Na2CO3 > NaHCO3
|
||
|
与盐酸反应 |
Na2CO3+2HCl == 2NaCl+CO2↑+H2O |
NaHCO3+HCl==NaCl+H2O+CO2↑ |
|
反应速率: NaHCO3 >Na2CO3 |
||
|
与氯化钙溶液 |
Na2CO3+CaCl2==CaCO3↓+ 2NaCl (CO32―+Ca2+==CaCO3↓) |
------- |
|
与澄清石灰水 |
Na2CO3+Ca(OH)2==CaCO3 ↓+2NaOH (CO32―+Ca2+==CaCO3↓) |
NaHCO3+Ca(OH)2== NaOH + CaCO3↓ +H2O (HCO3―+OH―+Ca2+==CaCO3↓+H2O) 或NaHCO3+Ca(OH)2==Na2CO3 +CaCO3↓+2H2O (2HCO3―+2OH―+Ca2+ =CaCO3↓+2H2O+CO32―) |
|
与氢氧化钠溶液 |
----- |
NaOH+NaHCO3 ==Na2CO3+H2O
(OH―+HCO3―==CO32―+H2O) |
|
热稳定性 |
稳定 |
2NaHCO Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
|
相互 转化 |
 Na2CO3
NaHCO3: Na2CO3
NaHCO3:Na2CO3+CO2+H2O==2NaHCO3 NaHCO3  Na2CO3 : Na2CO3 :NaOH+NaHCO3 ==Na2CO3+H2O (OH―+HCO3―==CO32―+H2O) 2NaHCO  Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
[板书](三)铝的化合物------氧化物与氢氧化物
[投影总结]
|
物质 |
氧化铝 |
氢氧化铝 |
|
|
化学式 |
Al2O3 |
Al(OH)3 |
|
|
俗名 |
刚玉 |
------ |
|
|
物理性质 |
白色粉末,不溶于水,熔点高,自然界中为无色晶体。 |
白色固体,不深于水 |
|
|
化 学 性 质 |
与酸 反应 |
Al2O3 +6HCl==AlCl3
+3H2O (Al2O3+6H+==Al3++3H2O) |
Al(OH)3+3HCl==AlCl3+3H2O (Al(OH)3+3H+==Al3++3H2O) |
|
与碱 反应 |
Al2O3+2NaOH==2NaAlO2+
H2O (Al2O3+2OH―=2AlO2― +H2O) |
Al(OH)3+NaOH=NaAlO2+ 2H2O
Al(OH)3+OH―=AlO2―+2H2O |
|
|
相互转化 |
---- |
2Al(OH)3  Al2O3+3H2O Al2O3+3H2O
|
[板书](四)铁的化合物
3、存在过量问题时,要根据不过量的物理量来进行计算。
[自我评价]
用AgNO3 溶液和NaCl 、MgCl2、AlCl3三种溶液分别反应时,若把同体积、同物质的量浓度的三种溶液中的Cl― 全部沉淀下来,所需AgNO3 溶液的体积比是___________;若把同体积的三种溶液中的Cl― 全部沉淀下来,所用AgNO3 溶液体积相同,则此三种溶液中溶质的物质的量浓度之比为_________,生成沉淀的质量比为___________。
2、计算时要注意物质的量与其他各物理量(如质量、气体体积、浓度等)之间的关系。
1、化学方程式中各物质的化学计算数之比等于各物质的物质的量之比,这是进行各项计算的最根本依据。
0.01 z y x
∴x==0.01 mol y==0.01 mol z==0.02 mol
(1) 标准状况下生成H2 体积 V(H2)==0.04*22.4==0.224L
(2)
c(Zn2+)== ==0.2 mol/L
==0.2 mol/L
n(H+)==n(HCl)-z==0.05-0.02==0.03 mol
c (H+)== ==0.6 mol/L
==0.6 mol/L
[总结]综合以上计算,物质的量应用于化学方程式的计算时,须注意以下几点:
0.1mol n(HCl) V(H2 )
(2)n(HCl)=0.1mol×2=0.2mol
(3)V(H2 )=0.1×22.4L=2.24L
[讲]在化学反应中,反应物间是按化学方程式所确定的质量比或物质的量比进行反应的。如果某一反应中两种反应物的量都已给出。此时存在两种可能,一种是两种反应物恰好完全反应;二是两种反应物不是恰好完全反应。而是一种反应物过量,这时就首先确定哪种反应物的量是过量的,然而根据不足量的物质,即完全反应的物质的量进行有关计算。下面我们按以上思路来解答。
[板书]例2、将0.65g 锌加到50 mL 1 mol /L盐酸中,计算:
(1) 标准状况下,生成H2 的体积
(2) 若反应完成后,溶液体积仍为50 mL,这时溶液中的Zn2+和H+ 的物质的量浓度是多少?
解:n(Zn)==0.65/65==0.01 mol
n(HCl)==0.05*1==0.05 mol
∵ Zn +2HCl ==ZnCl2 +H2 ↑
∴ HCl 过量
∴ 设生成 H2 x mol , ZnCl2 y mol , HCl z mol
Zn +2HCl ==ZnCl2 +H2 ↑
1 2 1 1
4、进行计算。
[过]下面我们就在掌握上述各物理量间关系的基础上,来系统、全面地学习物质的量应用于化学方程式的计算。
[板书]例1、把6.5 g Zn 放入足量盐酸中,锌完全反应,计算:
(1) 6.5g Zn 的物质的量
(2) 参加反应的HCl 的物质的量
(3) 生成H2 的体积(标准状况)
解:(1)n(Zn)=m/M=6.5g/65g.mol-1=0.1mol
Zn + 2HCl = ZnCl2 + H2↑
1mol 2mol 22.4L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com