
1、常见的氧化剂
(1) 活泼的非金属单质:O2、Cl2、Br2
(2) 含高价金属阳离子的化合物:FeCl3
(3) 含某些较高化合价元素的化合物:浓H2SO4 、HNO3、KMnO4、MnO2
2、线上标明电子得失数。
[点击试题]用双线桥表示下列氧化还原反应,并指出氧化剂和还原剂。
(1) 3 H2 + Fe2O3 === 3H2O + 2Fe
(2) 2KClO3 === 2KCl + 3 O2
(3) 2H2S +SO2 == 3 S+2H2O
[板书](2) 单线桥--表示电子转移情况

[投影小结]步骤:重点:
(1)单箭号(在反应物之间);
(2)箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素;
(3)只标转移电子总数,不标得与失(氧化剂得电总数等于还原剂失电子总数)。
[过]下面根据我们已有的经验,总结一下常见的氧化剂和还原剂。
[板书]3、常见的氧化剂与还原剂
[投影小结]
1、先标化合价,双线桥从左指向右连接不同价态的同种元素。
3、氧化剂和还原剂在氧化还原反应中分别表现什么性质?起何作用?
[讨论并小结]得电子(或电子对偏向)的物质为氧化剂。失电子(或电子对偏离物质)的物质为还原剂。在氧化还原反应中,氧化剂得到了电子,所含元素化合价降低,发生了还原反应;还原剂失去了电子,所含元素化合价升高,发生了氧化反应。氧化剂具有氧化性,得电子的性质;还原剂具有还原性,即失电子的性质。
[板书]1、氧化剂和还原剂(反应物)
氧化剂:得电子(或电子对偏向)的物质------氧化性
还原剂:失电子(或电子对偏离)的物质------还原性
[讲]在氧化还原反应中,氧化剂得电子具有氧化性,起氧化作用,本身被还原后的生成物叫还原产物。还原剂失电子具有还原性,起还原作用,本身被氧化,氧化后的生成物叫氧化产物。
[板书]氧化产物:氧化后的生成物
还原产物:还原后的生成物。
[总结]氧化还原反应中各概念间的关系为
[板书]
 氧化剂 + 还原剂 == 还原产物 + 氧化产物
氧化剂 + 还原剂 == 还原产物 + 氧化产物
[过]氧化还原反应的实质是电子的转移,下面我们学习如何在方程式上简单地表示反应中电子的转移情况。
[板书]2、氧化还原反应中电子转移的表示方法
(1) 双线桥法---表示电子得失结果

[投影小结]步骤:
2、氧化剂和还原剂在氧化还原反应中本身所发生的反应是什么?所含元素的化合价的情况如何?
5、CaCO3+H2O+CO2====== Ca(HCO3)2
[过]在反应1中,H2――H2O 的变化实质是失去了电子,被氧化,而CuO ---Cu 的变化实质是得到了电子,被还原。其中,H2 为CuO 的还原提供了电子,CuO 为H2 的氧化接受了电子,从而使双方完成了氧化还原反应。在这里,H2 起还原作用称为还原剂,CuO 起氧化作用称为氧化剂。
[板书]二、氧化剂和还原剂
[问]1、从电子转移的角度分析什么是氧化剂?什么是还原剂?
4、2H2O2======2H2O+O2↑
3、3NO2+H2O======2HNO3+NO
2、MnO2+4HCl(浓)======MnCl2+H2O+Cl2↑
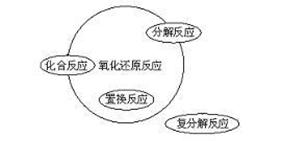
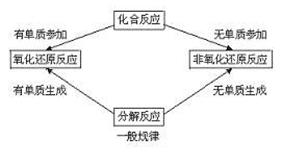
3、常见的氧化剂与还原剂
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com