
1、『2008广东高考』镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如右图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。

(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氧化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

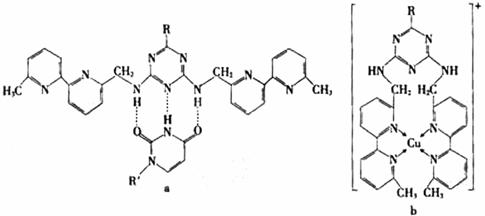
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
。
答案:(1) 以MgCl2为原料用熔融盐电解法制备Mg时,常加入NaCl、KCl、或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有:增大离子浓度,从而增大熔融盐的导电性。
(2) 请更正图中错误:⑧应为黑色。
(3) 请用原子结构的知识解释发光的原因:原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从内侧轨道跃迁到外侧的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来轨道,并向外界释放能量(光能)。
(4) 解释表中氟化物熔点差异的原因:NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高。又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF。
(5) ①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有:σ键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用的差异:a中微粒间的相互作用为氢键,b中微粒间的相互作用为配位共价键。
3.物质溶沸点的比较(重点)
(1)不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体
 (2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。
(2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。
③原子晶体:键长越小、键能越大,则熔沸点越高。
(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质
『综合训练题』
2、非极性键和极性键的比较
|
|
非极性键 |
极性键 |
|
概念 |
同种元素原子形成的共价键 |
不同种元素原子形成的共价键,共用电子对发生偏移 |
|
原子吸引电子能力 |
相同 |
不同 |
|
共用电子对 |
不偏向任何一方 |
偏向吸引电子能力强的原子 |
|
成键原子电性 |
电中性 |
显电性 |
|
形成条件 |
由同种非金属元素组成 |
由不同种非金属元素组成 |
1、离子键、共价键和金属键的比较
|
化学键类型 |
离子键 |
共价键 |
金属键 |
|
概念 |
阴、阳离子间通过静电作用所形成的化学键 |
原子间通过共用电子对所形成的化学键 |
金属阳离子与自由电子通过相互作用而形成的化学键 |
|
成键微粒 |
阴阳离子 |
原子 |
金属阳离子和自由电子 |
|
成键性质 |
静电作用 |
共用电子对 |
电性作用 |
|
形成条件 |
活泼金属与活泼的非金属元素 |
非金属与非金属元素 |
金属内部 |
|
实例 |
NaCl、MgO |
HCl、H2SO4 |
Fe、Mg |
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别.
|
晶体类型 |
原子晶体 |
分子晶体 |
金属晶体 |
离子晶体 |
|
粒子 |
原子 |
分子 |
金属阳离子、自由电子 |
阴、阳离子 |
|
粒子间作用(力) |
共价键 |
分子间作用力 |
复杂的静电作用 |
离子键 |
|
熔沸点 |
很高 |
很低 |
一般较高,少部分低 |
 较高 较高 |
|
硬度 |
很硬 |
一般较软 |
一般较硬,少部分软 |
较硬 |
|
溶解性 |
难溶解 |
相似相溶 |
难溶(Na等与水反应) |
易溶于极性溶剂 |
|
导电情况 |
不导电 (除硅) |
一般不导电 |
良导体 |
固体不导电,熔 化或溶于水后导电 |
|
实例 |
金刚石、水晶、碳化硅等 |
干冰、冰、纯硫酸、H2(S) |
Na、Mg、Al等 |
NaCl、CaCO3 NaOH等 |
例38.下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al D晶格能由大到小: NaF> NaCl> NaBr>NaI
例39.关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
3.了解氢键的存在对物质性质的影响(对氢键相对强弱的比较不作要求).
NH3、H2O、HF中由于存在氢键,使得它们的沸点比同族其它元素氢化物的沸点反常地高.
影响物质的性质方面:增大溶沸点,增大溶解性
表示方法:X-H……Y(N O F) 一般都是氢化物中存在
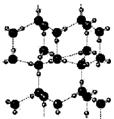 例35.右图为冰晶体的结构模型,大球代表O原子,小球代表H原子.
例35.右图为冰晶体的结构模型,大球代表O原子,小球代表H原子.
下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
 D.冰晶体熔化时,水分子之间的空隙增大
D.冰晶体熔化时,水分子之间的空隙增大
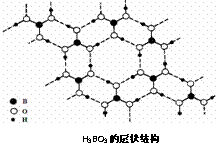
例36.正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图).下列有关说法正确的是
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
例37.一定压强和温度下,取两份等体积氟化氢气体,在35℃和90℃时分别测得其摩尔质量分别为40.0g/mol和20.0g/mol.
(1).35℃氟化氢气体的化学式为___________________.
(2).不同温度下摩尔质量不同的可能原因是________________________________________.
例37.(1).(HF)2
(2).在较低温度下HF以氢键结合而成(HF)n(n=2、3、……),其摩尔质量大于HF的摩尔质量;随着温度升高,氢键不断被破坏,气体摩尔质量减小.
2.知道分子晶体的含义,了解分子间作用力的大小对物质某些物理性质的影响.
(1).分子晶体:分子间以分子间作用力(范德华力、氢键)相结合的晶体.典型的有冰、干冰.
(2).分子间作用力强弱和分子晶体熔沸点大小的判断:组成和结构相似的物质,相对分子质量越大,分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔、沸点越高.但存在氢键时分子晶体的熔沸点往往反常地高.
例33.在常温常压下呈气态的化合物、降温使其固化得到的晶体属于
 A.分子晶体 B.原子晶体 C.离子晶体 D.何种晶体无法判断
A.分子晶体 B.原子晶体 C.离子晶体 D.何种晶体无法判断
例34.下列叙述正确的是
A.分子晶体中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
1.知道分子间作用力的含义,了解化学键和分子间作用力的区别.
分子间作用力:把分子聚集在一起的作用力.分子间作用力是一种静电作用,比化学键弱得多,包括范德华力和氢键.
范德华力一般没有饱和性和方向性,而氢键则有饱和性和方向性.
1.[2008肇庆一模]水是生命之源,也是一种常用的试剂。请回答下列问题:
 (1)水分子中氧原子在基态时核外电子排布式为___ _______;
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
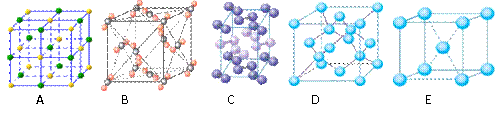
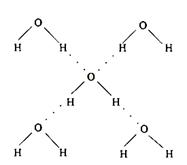 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(7)分析下表数据,请写出你出的最具概括性的结论:
① ;
② 。
|
键型 |
键能 (kJ/mol) |
键长 (pm) |
分子 |
键角 |
物质 |
熔点(℃) |
沸点(℃) |
|
H-C |
413 |
109 |
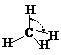 |
109.5º |
甲烷 |
-183.7 |
-128.0 |
|
H-N |
393 |
101 |
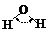 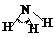 |
107 º |
氨 |
-77.7 |
-33.3 |
|
H-O |
463 |
96 |
|
104.5 º |
水 |
0.0 |
100.0 |
(1)1S22S22P6 (1分) (2)(1分)sp3 (3)(1分)A
(4)(2分)BC (5)(1分)20 (6)(1分)Cu2++4H2O=[Cu(H2O)4]2+
|
②上述氢化物氢原子间相离越远、分子越对称,分子间作用越弱(1分)

2[2008南海一模] 下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
|
|
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的常见化合物的晶体类型是________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(5) 1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。


在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
(1)⑨ (1分) (2)苯 (1分) 分子晶体 (1分)(3) 1 (1分)三角锥形 (1分)(4) Be(OH)2+2NaOH=Na2BeO2+2H2O (1分)(5)8 (1分)12 (1分)
3[2008惠州二模] 已知:
|


|




 R-CH2-C-CH2-R’
R-CH2-C-CH2-R’
|
|
|
|
 O
O
已知:A的结构简式为:CH3-CH(OH)-CH2-COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。
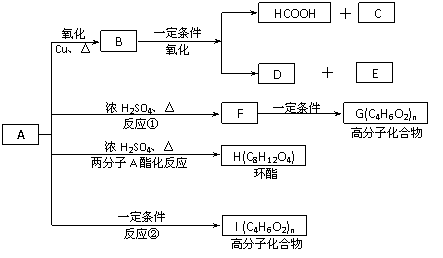

(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
(1)C:HOOC-CH2-COOH (2分)、 E:HOOC-COOH(2分)、
(2)消去,缩聚(各1分,共2分,答聚合也给分)
(3)
 ②
②
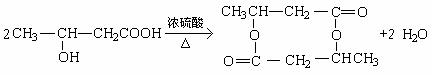
③
|
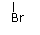 (ⅰ)CH3CHCH3 --------→CH3CH==CH2 + (CH3)2CHOC2H5+HBr
(ⅰ)CH3CHCH3 --------→CH3CH==CH2 + (CH3)2CHOC2H5+HBr
|
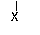 (ⅱ)CH3CH2CHCH3------→CH3CH==CHCH3+ CH3CH2CH==CH2+HX
(ⅱ)CH3CH2CHCH3------→CH3CH==CHCH3+ CH3CH2CH==CH2+HX

X为Cl 65% 35%
X为Br 75% 25%
X为I 80% 20%
(1)根据上面两个反应的条件及其数据,请写出你认为最具概括性的两条结论:① 。
②
。
 (2)由丙烯经下列反应可制得化工原料H及F、G两种高分子化合物(它们都是常用的塑料),其合成线路如下:
(2)由丙烯经下列反应可制得化工原料H及F、G两种高分子化合物(它们都是常用的塑料),其合成线路如下:

请完成下列填空:
①写出结构简式:聚合物F是 ,产物H ;
②B转化为C的化学方程式为: ;
③在一定条件下,两分子E能脱去两分子水形成一种元环状化合物,该化合物的结构简式是 。
4(1)[根据答到的要点或关键词给分]
①在此条件下,卤代烃的消去反应和取代反应同时进行(1分),有利于消去反应(1分)。
②在此条件下,有利于生成对称稀烃(1分),且卤原子半径越大(1分)越有利于生成对称稀烃(1分)。
若回答只是数据翻译,如:消去(取代)产物比例较大(小),或消去反应谁的比例大、谁的比例小,说出一点给1分,说出几点都如此最多给2分。
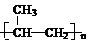
(2)① (1分) CH3C≡CH (1分)
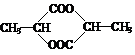
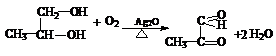 ②
(2分) ③
(1分)
②
(2分) ③
(1分)
第六讲
7.了解简单配合物的成键情况(配合物的空间构型和中心原子的杂化类型不作要求).
|
概念 |
表示 |
条件 |
|
共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。 |
 A
B A
B电子对给予体 电子对接受体 |
其中一个原子必须提供孤对电子,另一原子必须能接受孤对电子的轨道。 |
(1)配位键:一个原子提供一对电子与另一个接受电子的原子形成的共价键.即成键的两个原子一方提供孤对电子,一方提供空轨道而形成的共价键.
(2)①.配合物:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键形成的化合物称配合物,又称络合物.
②形成条件:a.中心原子(或离子)必须存在空轨道. b.配位体具有提供孤电子对的原子.
③配合物的组成.
④配合物的性质:配合物具有一定的稳定性.配合物中配位键越强,配合物越稳定.当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关.
例30.下列不属于配合物的是
A.[Cu(NH3)4]SO4·H2O B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O D.Na[Al(OH) 4]
例31.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
例H3)5BrSO4可形成两种钴的配合物.已知两种配合物的分子式分别为[Co(NH3)5Br] SO4 和[Co (SO4) (NH3)5] Br, 若在第一种配合物的溶液中加入BaCl2 溶液时,现象是 ;若在第二种配合物的溶液中加入BaCl2溶液时,现象是 ,若加入 AgNO3溶液时,现象是 .
例32.产生白色沉淀 无明显现象 产生淡黄色沉淀
『综合模拟训练』
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com