
3.NA为阿伏加德罗常数,下列叙述正确的是
A.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
B.1mol过氧化氢分子中共用电子对数为3NA
C.用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属
D.0.1mol Na2CO3·10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA
2.某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物 ②煤和石油都是可再生能源 ③不锈钢和目前流通的硬币都是合金 ④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 ⑤蛋白质溶液、淀粉溶液和雾都是胶体。上述说法正确的是
A.①③⑤ B.①②④ C.②③④ D.③④⑤
1.下列做法不能体现低碳生活的是
A.减少食物加工过程 B.大量使用薪柴为燃料
C.尽量购买本地的、当季的食物 D.注意节约用电
2.分散系的比较
|
分散系 种类 |
溶液 |
胶体 |
浊液 |
|||
|
水溶液 |
非水溶液 |
粒子胶体 |
分子胶体 |
悬浊液 |
乳浊液 |
|
|
分散质粒子 |
离子或分子 |
分子 |
分子或离子的集合体 |
大分子 |
巨量分子集合的颗粒 |
巨量分子集合的液滴 |
|
举例 |
食盐水 |
碘酒 |
Fe(OH)3胶体 |
淀粉溶液 |
石灰乳 |
牛奶 |
|
分散质粒子直径⑴ |
1n m |
1nm-100n m |
100n m |
|||
|
均一性⑵ |
|
|
|
|||
|
稳定性⑶ |
|
|
久置沉降 |
久置分层 |
||
|
能否通过滤纸⑷ |
|
|
|
|||
|
能否通过半透膜⑸ |
|
|
|
|||
|
有无丁达尔效应⑹ |
|
|
- |
试题枚举
[例1]右图是M、N两种不含结晶水的固体物质的溶解度曲线。下列说法中正确的是
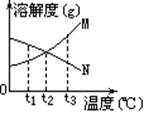 A.t1℃时,N比M的溶解度大
A.t1℃时,N比M的溶解度大
B.温度从t1℃升高到t3℃时,N的饱和溶液中溶质的质量分数将增大
C.M比N的溶解度大
D.N中含有少量M时,可用降温结晶法提纯N
解析:由图可看出,t1℃时N比M的溶解度大, A正确。因N的溶解度随温度的升高而降低,故从t1℃升高到t3℃时N的饱和溶液中溶质的质量分数将减小, B错。温度高于t2℃时M的溶解度大于N,温度低于t2℃时,M的溶解度小于N, C错。N中含有少量M时,可用升温结晶法提纯N,D错。
答案: A
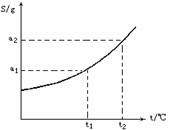 [例2]摩尔质量为M g/mol的某物质的溶解度曲线如图所示,现有t2℃ 300g该物质的溶液,在温度不变时蒸发掉50 g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ
g/mL,则饱和溶液的物质的量浓度为____mol/L,若将此饱和溶液降温至t1℃时,析出无水物晶体的质量为______g。
[例2]摩尔质量为M g/mol的某物质的溶解度曲线如图所示,现有t2℃ 300g该物质的溶液,在温度不变时蒸发掉50 g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ
g/mL,则饱和溶液的物质的量浓度为____mol/L,若将此饱和溶液降温至t1℃时,析出无水物晶体的质量为______g。
解析:由溶解度曲线可知,在t2时,该物质的溶解度为a2g,
饱和溶液的溶质质量关分数可用下式计算: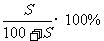
再根据物质的量浓度和溶质质量分数的换算公式,求出溶液的物质的量浓度。
由t2℃的溶解度数据可求出溶液的溶质质量分数 =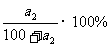 。
。
溶液的物质的量浓度=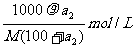
设降温至t1时,析出的晶体的质量为χ
根据公式:100+S(高温)∶S(高温)-S(低温)=高温下饱和溶液质量∶析出晶体质量
(100 +a2)∶(a2-a1)=(300-50)∶χ
χ=250(a2-a1)/(100+a2)g
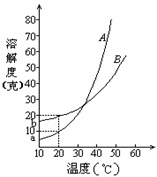 [例3]A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50克混和物,将它溶于100克热水,然后冷却至20℃。若要使A析出而B不析出,则混和物中B的质量百分比(B%)最高不能超过多少?(写出推理及计算过程。)
(2)取W克混和物,将它溶于100克热水,然后冷却至10℃。若仍要使A析出而B不析出,请写出在下列两种情况下,混和物中A的质量百分比(A%)应满足什么关系式。(以W、a、b表示。只需将答案填写在下列横线的空白处.)
当W<a+b时,A%
[例3]A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50克混和物,将它溶于100克热水,然后冷却至20℃。若要使A析出而B不析出,则混和物中B的质量百分比(B%)最高不能超过多少?(写出推理及计算过程。)
(2)取W克混和物,将它溶于100克热水,然后冷却至10℃。若仍要使A析出而B不析出,请写出在下列两种情况下,混和物中A的质量百分比(A%)应满足什么关系式。(以W、a、b表示。只需将答案填写在下列横线的空白处.)
当W<a+b时,A%
当W>a+b时,A% 。
解析:(1)因为在20℃时,A的溶解度为10g,B的溶解度为20g,所以50gA和B的混合物溶于100g热水中,降温至20℃时,要使B不析出,A能析出,则在50g混合物中,B的质量应≤20g,A的质量应≥30g,即在50g混合物中B的质量分数应≤40%。
(2)要使B不析出,B的质量≤b,而A要析出,A的质量应>a。当W<a+b时,只要A>a,即可满足条件,所以A%>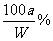 。当W>a+b时,B≤b即可满足条件,所以A%≥
。当W>a+b时,B≤b即可满足条件,所以A%≥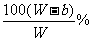
[例4]氯化铁溶液和氢氧化铁胶体具有的共同性质是( )
A.分散系颗粒直径都在1~100nm之间
B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
解析:溶液中溶质颗粒直径都小于1nm,胶体中胶粒直径都在1~100 nm之间,前者能透过半透膜,后者不能透过半透膜。加热蒸干时,氯化铁水解为氢氧化铁,灼烧后,氢氧化铁分解为氧化铁,氧化铁溶液呈棕黄色,氢氧化铁胶体呈红褐色。
答案:C
1.概念:一种或几种物质分散到另一种物质中形成的混合物叫做分散系。被分散的物质叫做 ,物质分散于其中的物质叫做 。
3.胶体的制备:将少量饱和的氯化铁溶液加入沸水中,可制备氢氧化铁胶体。反应方程式如下: 。
思考:各举一例说明胶体特性的应用:
(1)丁达尔效应 (2)电泳现象
(3)不能透过半透膜 (4)吸咐性
2.胶体的性质:胶体的性质主要为 运动、 现象和 。
1.胶体的概念:分散质直径在 之间的分散系。胶体粒子不能通过 ,但能通过 。所以分离胶体与溶液的方法是 。
有关溶液的计算,除了必需掌握溶解度S、溶质的质量分数ω的计算公式外,还必需掌握饱和溶液中,溶解度S、溶质的质量分数ω、物质的量浓度c之间的换算关系:
7.风化与潮解 (1)风化: 。
①本质:结晶水合物分解。
Na2CO3·10H2O=Na2CO3十10H2O
(无色晶体) (白色粉末) ②现象: 。
(2)潮解: 。 易潮解的物质有:CaCl2,MgCl2,NaOH等。 ①粗盐易潮解,而精盐不易潮解。这是因为 。 ②一小块NaOH固体露置在空气中,会逐渐地 → → 。这是因为 。 ③因为NaOH易潮解,所以用它作干燥剂时常与CaO混合制成碱石灰,以防其潮解。
思考:下列说法是否正确?若不正确,请说明理由。
(1)溶解是一个物理变化过程,溶解过程中没有明显的能量变化。
(2)饱和溶液不一定是浓溶液,但不饱和溶液一定是稀溶液,所以饱和溶液的质量分数一定大于不饱和溶液。
(3)气体的溶解度随温度升高而减小,固体溶解度随温度升高而增大。
(4)某温度下,将一块氯化铵晶体投入饱和的氯化铵溶液中,氯化铵晶体不会发生任何变化。
(5)一定温度时,有晶体析出的溶液一定是饱和溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com