
2、王老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性高锰酸钾溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl3溶液,溶液呈血红色。判断下列说法中正确的是 ( )
1、室温下,把铜片放入浓硫酸中,没有明显的反应现象。对此,甲认为这是铜在浓硫酸里发生钝化现象;乙认为室温下铜片放入浓硫酸中看不到明显的现象,主要是因为铜与浓硫酸在室温下反应速率很慢。设计方案对甲和乙的假设进行说明。
5、针对有关问题,做一些专题训练。选取适当的例题,多让学生体验设计实验方案,综合运用高中阶段所学的化学知识,积极主动地去思考化学实验的实施过程,从而深化和发展知识。对于给出的不同方案要学会作出恰当的评价,让学生掌握评价实验方案的常见角度和方法,达到熟能生巧的境界。
4、注重学生发散性思维的训练,化学实验中的一个实验多种现象,一个实验现象多种原因,一种仪器多种用途,一种用途多种装置,一种仪器多种用法,一种物质多种制法,一组物质多种鉴别方法等问题,都是培养学生的发散性思维能力的好素材。
3、在对于实验数据及现象的分析、处理过程中,注重学生思维的有序性和条理性的训练,对于有关结论的概括,要训练学生用规范的语言来表达。
2、重视复习课本实验基本操作。对于每一个实验都弄清原理、相关的仪器装置,注重操作细节,对于每个实验,都要做到:(1)怎么做?(2)为什么要这样做?(3)如果不这样做,会引起什么后果?(4)还能怎么做?对实验中所涉及到的重要化学方程式和重要实验现象均应做到熟练。条件许可的话,尽可能地开放化学实验室,让学生重做一些重点实验,例如一些定量实验,感受实验细节,加深体验。
1、重视化学基本概念和理论的复习。探究性实验试题涉及化学知识的范围广泛,有关于化学基本概念原理方面内容的,也有关于元素化合物知识或有机官能团的性质及反应的。所以要讲究方法,注重实效,努力帮助学生弄清每一个概念和理论,为后续的复习工作打基础。
4、对具体问题的探究
例4:含有酚酞的氢氧化钠的溶液中,逐滴滴加新制氯水,边滴边振荡,直到红色褪去。
问:(1)氯水中存在分子_________________和离子__________________。
(2)氢氧化钠酚酞溶液褪色的原因可能是:
①____________________________________②_______________________ 。
(3)如何用实验证明你对褪色的原因的推测呢?简要叙述你的实验设计思路。
评析:解决问题的关键是找出红色消失的原因。所以首先分析氯水的组成,根据有关微粒的性质提出褪色原因的假设。在解题过程中,一些学生没有全面分析氯水的组成,也有的没抓住有次氯酸的漂白特点,从而造成解题上的障碍。
解答:向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色重现,则是因为HCl和HClO的酸性所致;若红色不再重现,则是因为HClO的强氧化性所致。
例5:请结合所学知识设计实验,证实AlO2−结合H+的能力比CO32−强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选)。
⑴应选试剂;⑵操作要点;(3)能证明AlO2−结合H+的能力强于CO32−的反应的原理的离子方程式。
评析:解决问题的关键在于把握有关化学原理。可如下分析:如果AlO2−和HCO3−相遇时,生成 Al(OH)3白色沉淀,即可AlO2−结合H+的能力强于CO32− 。
解答:⑴应选试剂:NaOH溶液、AlCl3溶液、NaHCO3溶液
(2)操作要点:①取少量的AlCl3溶液于试管中;②向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失;③向其中再滴入NaHCO3溶液至足量。
(3)离子方程式:AlO2−+HCO3−+H2O = Al(OH)3↓+CO32−
综上所述,在解决探究性试题的过程中,首先要明确实验目的和要求,然后结合问题运用有关化学知识和实验技能对实验的仪器、步骤、方法进行逐步的分析研究。其中,有关方案的设计要特别明确:首先原理要具有科学性,不能凭空捏造。其次要有对照性,往往为了更能够说明问题,一定要有正反两个方面的实验,考虑到各种因素可能对实验有影响所以要控制变量,只能有一个因素是变量,其余几个是一样的。最后实验装置要简易,操作必须安全可行,效果要明显。
二、复习策略
探究性实验题的解决对学生的综合能力要求较高。学生的科学方法和实验能力的培养并不是一朝一夕可以达到的,需要在教学中一点一滴持之以恒的训练。当然,在高三总复习阶段,我们仍然可以通过一些针对性的训练来启迪学生的思维,提高解决问题的能力。所以我们在复习中着重做了以下几方面的工作。
3、对实验方案的探究
例3:某校研究小组的同学想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和操作步骤。
(1) 任取两份氯酸钾,分别放入两支试管,在其中一份加入经过称量的ng氧化铜粉末。
(2) 将两份氯酸钾同时在相同的条件下加热,将放出的气体通入水中,观察放出气体的快慢。
(3) 停止加热,冷却,将原来混有氧化铜的混合物加水溶解,小心过滤,将滤出的固体物质洗涤并干燥。
(4) 观察滤出物的颜色、状态。
(5) 将滤出的固体和炭粉混合,在密闭容器中加热,并将反应生成的气体通入澄清石灰水中,观察实验现象。
问题一:从以上有关实验步骤的叙述中可发现操作方案还存在一些缺陷,请指出并加以改进。(其余略)
评析:本题是以学生熟知的KClO3分解制O2实验为载体,考查学生理解催化剂概念的程度,解决问题的关键就是紧扣催化剂的特征,改变反应速率而其反应前后的性质和质量都没有改变。在学生的答案中,多数同学都指出了步骤(4)中缺少称量干燥的滤出固体这一过程,而忽略了第一步中不严密之处“任取两份氯酸钾”。事实上,这是探究性实验设计的重要原则之一,控制变量原则。这是一组对照实验,要使实验结果具有说服力,必须控制变量。因为对某个实验的影响,会有很多的因素,实验正是要人为控制条件,使众多变量中,只能有一个因素是变量,其余几个是一样的。
(或HC≡CH+2Br2→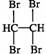 )
)
(2)不能 a、c
(3)H2S Br2+H2S→S↓+2HBr
(4) c b
(CuSO4溶液)(CuSO4溶液)
(5)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com