
7.王安石变法时所设立的“市易务”,其主要职责应该是 ( )
A.负责市场的税收 B.核准和监督市场的物价
C.管理对外贸易 D.调节市场物价和商品流通
6.唐朝时期的“海上丝绸之路”是指 ( )
A.从登州出发到达朝鲜、日本 B.从扬州出发到达朝鲜、日本
C.从广州出发到达马来半岛、波斯湾 D.从泉州出发到达红海沿岸、非洲东岸
5.下列关于三省六部制的说法中,正确的是 ( )
A.确立于唐太宗时期 B.门下省负责草拟和颁发皇帝诏令
C.尚书省负责官吏的考核和任命 D.分散了相权,加强了皇权
4.隋文帝时进行的重要改革包括①确立三省六部制度②废除九品中正制度③使府兵制与均田制相结合④部分推行以庸代役 ( )
A.①②③ B.①③④ C.①④ D.①②③④
3.下列关于《齐民要术》的说法,不正确的是 ( )
A.总结了黄河中下游地区的农牧业生产经验
B.是我国现存最早最完整的农书
C.强调了工商业发展的重要性
D.体现出这一时期民族融合的时代特征
2.从社会发展的角度看,商鞅变法的主要历史作用是 ( )
A.加强了秦国的专制主义中央集权制
B.废除秦国旧制度,使封建经济得到发展
C.秦国成为诸侯国中实力最强大的国家
D.为秦的统一奠定了基础
1.关于战国时期诸子百家思想地位的评价,正确的是 ( )
A.儒家思想居统治地位 B.墨家思想占主导地位
C.法家倍受统治者推崇 D.道家思想最受欢迎
32.如下图所示,若电解5min时铜电极质量增加2.16g,试回答:
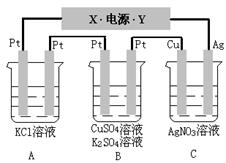
⑴电源电极X名称为______ _。
⑵电极反应:
A阳极:
阴极:
B 阳极:
阴极
C阳极:
阴极:
⑶ 通电5min时,B中共收集224mL气体(标况),溶液体积为200mL。(设电解前后无体积变化)则通电前CuSO4溶液的物质的量浓度为__________。
⑷ 若A中KCl溶液的体积也是200mL,电解后,溶液的pH是___________(设前后体无体积变化)
31.红磷P(S)和Cl2发生反应生成KCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
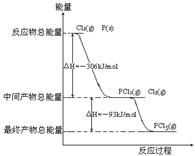 上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解
率α1等于 ;若反应温度由T1升高
到T2,平衡时PCl5分解率α2,α2 α1
(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2
反应生成中间产物PCl3,然后降温,再和Cl2
反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的
△H3= ;P和Cl2一步反应生成
1mol PCl5的△H4 △H1(填“大于”,“小于”或“等于”);
(5)P Cl5与足量水反应,最终生成两种酸,其化学方程式是 。
30.某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com