
3.(2008淅江金华)金华火腿闻名遐迩.某火腿公司有甲、乙、丙三台切割包装机,同时分别装质量为500克的火腿心片.现从它们分装的火腿心片中各随机抽取10盒,经称量并计算得到质量的方差如表所示,你认为包装质量最稳定的切割包装机是( )
A、甲 B、乙 C、丙 D、不能确定
2.(2008年浙江省衢州市)为参加电脑汉字输入比赛,甲和乙两位同学进行了6次测试,成绩如下表:
甲和乙两位同学6次测试成绩(每分钟输入汉字个数)及部分统计数据表
|
|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
平均数 |
方差 |
|
甲 |
134 |
137 |
136 |
136 |
137 |
136 |
136 |
1.0 |
|
乙 |
135 |
136 |
136 |
137 |
136 |
136 |
136 |
|
有四位同学在进一步算得乙测试成绩的方差后分别作出了以下判断,其中说法正确的是( )
A、甲的方差大于乙的方差,所以甲的成绩比较稳定;
B、甲的方差小于乙的方差,所以甲的成绩比较稳定;
C、乙的方差小于甲的方差,所以乙的成绩比较稳定;
D、乙的方差大于甲的方差,所以乙的成绩比较稳定;
1. (08浙江温州)体育老师对九年级(1)班学生“你最喜欢的体育项目是什么?(只写一项)”的问题进行了调查,把所得数据绘制成频数分布直方图(如图).由图可知,最喜欢篮球的频率是( )
A.0.16 B.0.24 C.0.3 D.0.4
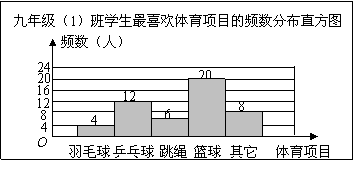
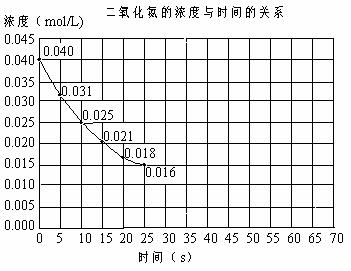
22.(8分)二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L。右图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
 (1)请计算前20秒内氧 气的平均生成速度:
(1)请计算前20秒内氧 气的平均生成速度:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:____________
宁乡县(1)5.5×10-4mol·L-1·s-1(2分)
(2)图中实线 (2分)
(3)图中虚线 (2分)
(4)k=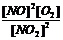 (2分)
(2分)
21.(14分)甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH___1(选填>,<,=)。简要说明pH试纸的使用方法: 。
(3)乙方案中,说明HA是弱电解质的现象是_________ 。
(4)请指出乙方案在实际运用中,存在的问题:
(5)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
⑴ 100mL容量瓶 (2分) ⑵ >(2分) 取一小段pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在pH试纸中央,对照比色卡,读出溶液的pH。(2分⑶ 装HA溶液的试管中放出H2的速率快(2分)
 ⑷
难以准确配制pH=1的弱酸HA溶液(2分); 不妥之处,固体的表面积对反应速率的影响大(2分)。
⑷
难以准确配制pH=1的弱酸HA溶液(2分); 不妥之处,固体的表面积对反应速率的影响大(2分)。
20.(4分)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是 ;配制完毕后要加入少量铁屑,其目的是 。
防221止水解 防止氧化
19.(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
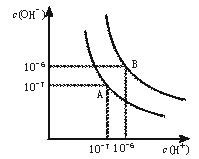 (2)将100℃下的pH=8的Ba(OH)2溶液与100℃下的
pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(2)将100℃下的pH=8的Ba(OH)2溶液与100℃下的
pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
(1)10-14 , 10-12 ; (2)2∶9; (3)0.004。
18.(4分)练习:已知在某温度时,K=7.32×10-3 ,下表为某时刻各物质的浓度值(mol/L),通过计算,请判断在此时刻可逆反应移动的方向
|
t |
C(N2) |
C(H2) |
C(NH3) |
平衡移动方向 |
|
t1 |
2 |
6 |
6 |
逆反应方向 |
|
t2 |
4 |
12 |
1 |
正反应方向 |
17.(8分)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
请回答下列问题:
(1)平衡时CO的转化率为 。
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
(3)427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
(1)50%(2分)(2)增大(2分)66.7%(或0.667)(2分)(3) ﹤(2分)
16.(16分)Ⅰ.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂
是 (填化学式)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中 c(OH-)的关系c(H+) c(OH-)。
Ⅰ171.(1)弱电解质 (2)H5IO6
Ⅱ.(1) NH4C1 ①
(2) NH4Cl和NH3·H2O(答NH4Cl和NH3也给分); NH4Cl和HCl
(3) 小于,大于
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com