
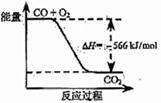
18.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+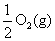 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)= 2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
17.燃烧a g乙醇(液),生成二氧化碳气体和液态水,放出的热量为QKJ,经测定,a g乙醇与足量钠反应,能生成标准状况下的氢气5.6L(氢气中H原子为羟基上H原子),则乙醇燃烧的热化学方程式书写正确的是
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -Q kJ/mol
B.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = - Q / 2 kJ/mol
C.1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -Q kJ/mol
D.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -2Q kJ/mol
16.已知H-H键能为436 KJ/mol,H-N键能为391KJ/mol,根据化学方程式:
N2 + 3H2 = 2NH3 ΔH= -92.4 KJ/mol,则N≡N键的键能是
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
15.S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法不正确的是:
A.△H3=-0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是放热反应
C.S(单斜,s)=== S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
14.已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3 C.1∶4 D.2∶3
13.一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入
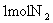 和
和 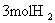 ,3min末测科容器内压强是起始时压强的0.9倍。在此时间内用
,3min末测科容器内压强是起始时压强的0.9倍。在此时间内用
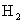 的量的变化来表示该反应的平均反应速率
的量的变化来表示该反应的平均反应速率
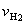 是
是
A.0.2mol/(L·min) B.0.6mol/(L·min)
C. 0.1mol/(L·min) D.0.3mol/(L·min)
12.已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3
( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3
mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3
( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3
mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A.一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
11.已知:(1)Zn(s)+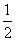 O2(g)===
ZnO(s),ΔH= -348.3 kJ·mol-1,
O2(g)===
ZnO(s),ΔH= -348.3 kJ·mol-1,
(2)2Ag(s)+ 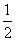 O2(g)===
Ag2O(s),ΔH= -31.0 kJ·mol-1,
O2(g)===
Ag2O(s),ΔH= -31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
10.根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B. Q1>Q3>Q2
C. Q3>Q2>Q1 D. Q2>Q1>Q3
9. 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率减小的是
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率减小的是
A.增加C的量
B.将容器体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com