
科目: 来源: 题型:
【题目】在某金属铁的样品中可能含有Zn、Mg、Al、Cu等杂质金属中的两种。取5.6g样品跟足量稀硫酸反应,得到0.2g氢气,则此铁的样品中不可能含有的杂质金属组是( )
A. Mg和Cu B. Mg和Zn C. Mg和Al D. Zn和Al
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下图所示溶解度曲线判断,下列说法不正确的是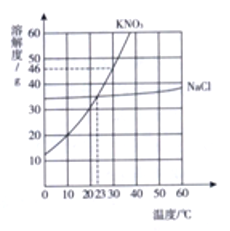
A. 30℃时,KN03的溶解度为46g
B. 23℃时,KNO3和NaCl的溶解度相等
C. 在坐标范围内,随着温度的升高,KN03的溶解度逐渐增大
D. lO℃时,向100g水中加入40gNaCl,得到140gNaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】李华同学为了测定某稀盐酸中氯化氢的质量分数,他在20g稀盐酸中滴加5.6%的氢氧化钾溶液,反应完全共用去氢氧化钾溶液l00g。
(化学反应方程式为:HCl + KOH = KCl+H2O)
请计算:(1)稀盐酸中中氯化氢的质量分数。(2)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,不属于置换反应的是( )
A. Cl2+2NaBr===2NaCl+Br2 B. Zn+CuSO4===ZnSO4+Cu
C. Fe2O3+3CO![]() 2Fe+3CO2 D. CuO+H2
2Fe+3CO2 D. CuO+H2![]() Cu+H2O
Cu+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn:7%、ZnO:31%、Cu:50%、CuO:5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
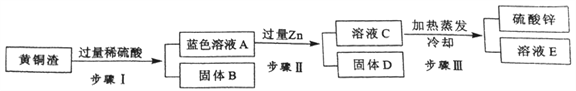
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
(1)步骤Ⅰ中产生气体的化学方程式为___________________。
(2)溶液A中的金属阳离子有__________(填化学式)
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为___,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是____。
(4)溶液A_____(填“大于”、“小于”或“等于”)溶液C的质量。
Ⅱ.在探究金属活动性的实验课上,同学们把打磨光亮的铝片插入硫酸铜溶液中,过一会儿,发现了一个“意外现象”:在铝片表面看到有红色固体析出的同时,还看到有少量的气泡冒出,写出生成红色固体的化学方程式___________________.
【提出问题】该气体是什么呢?
【猜想与假设】猜想一:O2 猜想二:H2 猜想三:CO2 猜想四:SO2
同学们经过讨论,一致认为猜想三不成立,理由是_____________________.
【实验验证】
(5)有同学闻了一下该气体,发现无气味,证明猜想四也不成立,理由是___________.
(6)将产生的气体经验纯后,用导管导入到点燃的酒精灯火焰上,气体安静燃烧,产生淡蓝色火焰.
【实验结论】__________________.
【反思与交流】CuSO4溶液可能显_______性(填“酸”或“碱”或“中”).
查看答案和解析>>
科目: 来源: 题型:
【题目】图示中A——F是初中化学常见的物质。按单质、氧化物、酸、碱、盐分类,A、B、C、D、E是五种不同类别的物质,F是大理石的主要成分。图中“--”表示相连的两种物质之间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物及反应条件已略去)。请回答:
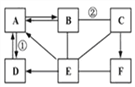
(1)物质F的化学式__________;
(2)反应②的化学方程式____________________;
(3)反应①的基本反应类型是_____________;
(4)E是由两种元素组成的,请写出其的一种用途_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:
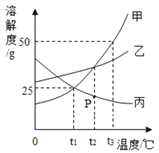
(1)t3℃时,将30g甲物质加入到 50g 水中,充分溶解后所得溶液的质量为______。
(2)若满足P点指标的氢氧化钙溶液中,加入少量的生石灰,则溶液中溶质的质量将_______(填“增加”、“减少”或“不变”) 。
(3)下列说法正确的是(填序号)____。
①t1℃时,甲、丙两溶液的溶质质量分数一定相等
②t3℃时,向100g20%甲的溶液中加100g水,充分搅拌,溶液的溶质质量分数为10%
③t2℃时,将甲和丙的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有甲和丙
④t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙。
查看答案和解析>>
科目: 来源: 题型:
【题目】小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量/g | 10.8 | 9.6 | 8.1 | 8.1 |
试计算:
(1)完全反应后生成二氧化碳的质量为____________g;
(2)求该珍珠粉中碳酸钙的质量分数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制取气体的发生装置和气体收集装置。回答下列问题:

(1)仪器a的名称是_________。
(2)实验室若用高锰酸钾制取氧气,可选择___作为发生装置,试管口还需放一团棉花的作用是_;其反应的化学方程式是____________,反应的基本类型是____。D、E、F、G都是实验室中气体的收集装置,其中不能用来收集氧气的是_______(填字母编号)。
(3)实验室制取二氧化碳时,不用大理石和稀硫酸制取的原因:___________。实验室制取二氧化碳时,选用B装置比A装置更好的理由是____,若用G装置收集二氧化碳时,验满的方法是_________,检验二氧化碳时,所发生反应的化学方程式为______。
(4)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气大,易溶于水且水溶液显酸性。实验室里,用亚硫酸钠固体和浓硫酸在常温下反应制取SO2。实验室制取SO2选择的发生装置是_______(填字母),若选择G装置收集SO2,气体应该从_______口(填“M”或“N”)进入,实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com