现有一种不纯的氧化铜粉末样品(杂质为铜粉),小刚和小强通过实验测定样品中氧化铜的质量分数.(提示:CuO+CO
Cu+CO
2)请你回答相关问题:
(1)小刚称取10g样品,利用下图所示装置进行实验,充分反应后,B装置增重4.4g,据此计算氧化铜样品中氧化铜的质量分数.
解:
B装置增重4.4g,为反应生成的二氧化碳的质量,设参见反应氧化铜的质量为x.
CuO+CO
Cu+CO
2
8044
x 4.4g
=
解得x=8.0g
该样品中氧化铜的质量分数=
×100%=80%
B装置增重4.4g,为反应生成的二氧化碳的质量,设参见反应氧化铜的质量为x.
CuO+CO
Cu+CO
2
8044
x 4.4g
=
解得x=8.0g
该样品中氧化铜的质量分数=
×100%=80%
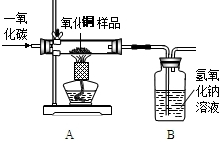
答:
该样品中氧化铜的质量分数80%
该样品中氧化铜的质量分数80%
(2)小强同学用同样的装置进行实验,实验结果与小刚所得的正确结果比较,出现偏差,请你分析造成误差的可能原因
若过早停止通氢气,使氧化铜没有被完全还原
若过早停止通氢气,使氧化铜没有被完全还原
.
(3)小刚是利用还原氧化铜的原理进行测定,请你简要写出其他测定样品中氧化铜的质量分数的方法和要测定的数据.(用文字叙述,无需写出具体质量数值)
先测出氧化铜样品的质量,再测出氧化铜样品和玻璃管的质量,然后通一氧化碳气体使其和氧化铜完全反应,实验结束后测固体和玻璃管的质量,根据质量减少的部分是氧化铜中氧元素的质量,计算出氧化铜的质量,再根据质量分数公式计算样品中氧化铜的质量分数
先测出氧化铜样品的质量,再测出氧化铜样品和玻璃管的质量,然后通一氧化碳气体使其和氧化铜完全反应,实验结束后测固体和玻璃管的质量,根据质量减少的部分是氧化铜中氧元素的质量,计算出氧化铜的质量,再根据质量分数公式计算样品中氧化铜的质量分数
.





 Cu+CO2)请你回答相关问题:
Cu+CO2)请你回答相关问题:
 Cu+CO2)请你回答相关问题:
Cu+CO2)请你回答相关问题: