
【题目】已知铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu,铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2。一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应。将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙。下列判断正确的是
Fe2O3+3Cu,铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2。一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应。将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙。下列判断正确的是
①甲中不含FeCl3
②甲中含有FeCl3
③若向固体丙加稀盐酸无明显现象,则滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2④若向固体丙加稀盐酸有气体产生,则滤液乙中可能含有ZnCl2、FeCl2,一定不含有CuCl2
A.①③ B.②③ C.①④ D.②④
【答案】A
【解析】
试题分析:铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu, 铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2以及Fe2O3+6HCl=2FeCl3+3H2O可以建立以下关系式:Fe2O3~2FeCl3~Cu根据铁在高温条件下与氧化铜反应:2Fe+3CuO
Fe2O3+3Cu, 铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2以及Fe2O3+6HCl=2FeCl3+3H2O可以建立以下关系式:Fe2O3~2FeCl3~Cu根据铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu可知生成物质氧化铁和铜的个数比是1:3,因此氯化铁一定能完全被铜反应,所以甲中不含FeCl3;所以溶液中存在FeCl2和CuCl2,由于相关金属的活动性顺序是锌>铁>铜,所以放入锌粒后锌首先置换出铜,所以固体若向固体丙加稀盐酸无明显现象,说明固体不是铁和锌,所以滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2,若向固体丙加稀盐酸有气体产生,说明固体可能是锌或铁,因此溶液中不可能含有CuCl2,一定含有ZnCl2可能含有FeCl2,综上所述①③正确;选A。
Fe2O3+3Cu可知生成物质氧化铁和铜的个数比是1:3,因此氯化铁一定能完全被铜反应,所以甲中不含FeCl3;所以溶液中存在FeCl2和CuCl2,由于相关金属的活动性顺序是锌>铁>铜,所以放入锌粒后锌首先置换出铜,所以固体若向固体丙加稀盐酸无明显现象,说明固体不是铁和锌,所以滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2,若向固体丙加稀盐酸有气体产生,说明固体可能是锌或铁,因此溶液中不可能含有CuCl2,一定含有ZnCl2可能含有FeCl2,综上所述①③正确;选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的试验流程(有些反应的部分反应物和生成物已省略).查阅资料发现常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H2O═Na2SiO2+2H2↑).
根据以上信息,回答下列问题:
(1)操作Ⅰ、Ⅱ的名称为 ,硅钢样品反应前须粉碎目的是 ;
(2)滤液B中的溶质为 ;
(3)写出步骤⑦中发生反应的化学方程式 ;其基本反应类型为 ;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在老师的帮助下,同学们制作了“叶脉书签”。制作中需用到10%的氢氧化钠溶液200 g,下图是配制该溶液的实验操作。

(1)操作①中,需称量氢氧化钠固体的质量是 g。
(2)操作②中,玻璃棒的作用是 ;在量取蒸馏水读数时,视线如右图所示(其他操作正确),会造成所配制溶液的溶质质量分数 (填“偏大”、“偏小”、“无影响”)。
(3)制作了“叶脉书签”后,同学们想用酸处理废液后再排放。欲测定处理后废液的酸碱度,需选用下列用品中的 (填序号)。
a.玻璃棒 b.白瓷板(或玻璃片) c.酚酞溶液 d.pH试纸
查看答案和解析>>
科目:初中化学 来源: 题型:
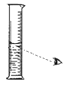
【题目】如图是甲、乙两种固体物质的溶解度曲线.
(1)t2℃时,甲物质的溶解度为 ;
(2)分析t1℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液.欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法 .(任填一种方法)
(3)将t1℃时甲和乙的饱和溶液同时升高t2℃,所得溶液中溶质的质量分数的大小关系是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对实验现象的描述正确的是
A.木炭在氧气中燃烧发出白光,生成二氧化碳
B.镁在空气中燃烧发出耀眼的白光,产生白色烟雾,生成白色固体
C.碱式碳酸铜在稀盐酸中逐渐溶解,有气泡产生,溶液由无色变成黄色
D.硫在空气中燃烧,发出淡蓝色火焰,产生有刺激性气味的气体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学对探究分子性质的实验(图1)进行了改进。如图2所示,试管丁、戊中各有一张每隔2厘米滴有一滴酚酞溶液的滤纸条,装有适量浓氨水的小药瓶固定在橡皮塞上,试管丁中小药瓶上的瓶塞已塞紧,试管戊中的小药瓶上无瓶塞。以下说法错误的是

A.图2比图1的实验更环保、更节约
B.图1和图2的实验均能证明分子在不断的运动
C.浓盐酸有挥发性,仅将浓氨水换成浓盐酸也可达到实验目的
D.若将戊浸入冰水中,滤纸条也会变红
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。某兴趣小组同学对其进行探究。
一、过氧化钙的性质研究
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条 ,说明过氧化钙与水反应有氧气生成。
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈 性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
二、过氧化钙的制备研究
实验室用钙盐制备CaO2,其主要实验装置(图1)和流程(图2)如下:

(3)图1试管中的物质是NH4Cl和Ca(OH)2,加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为 。
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需
要控制温度在0℃左右,采用的操作是将反应容器放置在 中,反应温度不能过高
的原因是:①防止氨水挥发;② 。
(5)“过滤”所得的副产品NH4Cl可做化肥中的 肥。检验“水洗”已经洗净的方
法是:取最后一次洗涤液少量于试管中, 。
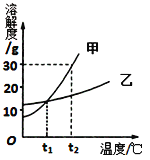
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2 ![]() 2CaO+O2↑)。
2CaO+O2↑)。
右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。
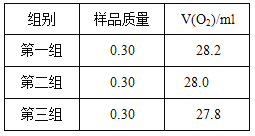
若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度![]() ,此方案测定结果偏小的原因可能是 。
,此方案测定结果偏小的原因可能是 。
[
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用的制备气体的装置如下图所示,请根据要求完成问题。

① 写出仪器名称:Ⅰ (1) ;Ⅱ (2) ;
② 用氯酸钾和二氧化锰的混合物制取较干燥的氧气可选择的发生和收集装置是 (3) (填装置编号);
③ 制取下列气体可以用启普发生器作为发生装置的是(4) 。
a.双氧水与二氧化锰粉末混合制取氧气
b.实验室制取二氧化碳
c.用锌粒和稀硫酸制取氢气
④ 要制取0.02mol氢气,至少需要多少克锌粒和足量稀硫酸反应?(请根据化学方程式列式计算) (5)
⑤ 从废旧干电池中回收的MnO2含有C,为得到纯净的MnO2并测定MnO2的含量,取该混合物用下图装置进行实验(夹持装置已略去)。
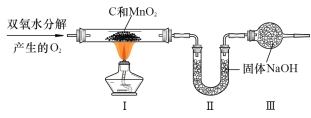
Ⅰ.实验中,用双氧水与二氧化锰混合制取氧气的化学方程式是 (6) ;为得到平稳的氧气流选用的发生装置是 (7) (选填A~G的装置编号)。
Ⅱ.下列数据中可以用来计算样品中MnO2的含量的是 (8)。(假设每步反应均完全且称量准确)
a.反应前后氧气发生装置的质量 b.反应前后装置Ⅰ中固体的质量
c.反应前后装置Ⅱ中固体的质量 d.反应前后装置Ⅲ中固体的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:

【定性研究】
(1)如图甲,可通过观察_________________来定性比较两者的速率影响效果。
【定量研究】
(2)如图乙,实验前检查该装置气密性的方法是__________________________。要定量比较两者的速率影响效果,可测量生成等体积气体所需的_______________。
【深入研究】
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:___________影响过氧化氢的分解速率;
猜想3:___________影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。 | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。 | 证明是Fe3+影响过氧化氢的分解速率 |
(4)【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com