
【题目】碳酸锂作为锂的基础锂盐,广泛用于玻璃制造和陶瓷生产过程中的添加剂,也是制备锂电池的重要原料。碳酸锂在热水中的溶解度很小,工业上以锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质)为原料制取碳酸锂的硫酸法生产工艺流程如下

(1)锂辉石热酸浸提前要进行“研磨”,其目的是_____
(2)“水浸”中加入CaCO3的作用之一是为了调节pH=5,让溶液中的Al3+变成Al(OH)3沉淀出来,要确定溶液的pH值为5,可以用pH试纸来测定,其操作方法是_____
(3)“沉锂”中加入的Na2CO3溶液是饱和溶液,其作用是_____,反应的化学方程式为_____
(4)“洗涤”中使用热水,原因是_____,证明洗涤干净的方法是_____
(5)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,锂元素浸出率的数据如下表
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①本实验中,编号为_____两组实验能说明温度对锂元素浸出率的影响
②根据上表数据,MgSO4用量对锂元素浸出率的影响是_____
③在工业生产过程中,相当数量的硫酸和纯碱变成了价值较低的Na2SO4等物质,从而造成了生产成本的提高,为了降低生产成本,除了尽可能减少硫酸的配量外,降低能源消耗也是一个方面,因此,可以继续设计实验,以探究出最佳锂元素浸提工艺条件,下列设计合理的是_____(填字母)
A 矿酸比1:2,硫酸浓度98,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98,MgSO4用量1.25,温度200℃
C 矿酸比1:2,硫酸浓度98,MgSO4用量2.50,温度200℃
D 矿酸比1:2,硫酸浓度98,MgSO4用量2.50,温度250℃
【答案】增大矿物与酸的接触面积,加快热酸浸提的速率 将一小片pH试纸放在白瓷板上,用干燥玻璃棒蘸取溶液滴到pH试纸上,再与标准比色卡比对,读出pH 提高反应物的浓度,有利于Li2SO4转化为Li2CO3 Li2SO4+Na2CO3==Na2SO4+Li2CO3↓ 碳酸锂在热水中溶解度很小,避免了洗涤过程中碳酸锂的损耗 取少量洗涤后的溶液于试管中,滴入足量稀盐酸,充分反应后滴入氯化钡溶液,若无明显现象,则已洗涤干净 2和3 其他条件相同时,增大MgSO4的用量,锂元素的浸出率提高 CD
【解析】
(1)锂辉石要粉碎成细颗粒的目的是增加接触面积,使反应充分,加快热酸浸提的速率;
(2)用pH试纸来测定,其操作方法是:将一小片pH试纸放在白瓷板上,用干燥玻璃棒蘸取溶液滴到pH试纸上,再与标准比色卡比对,读出pH;
(3)加入Na2CO3溶液是饱和溶液可以提供浓度大的溶液,可以使Li2SO4转化为Li2CO3;硫酸锂和碳酸钠反应生成硫酸钠和碳酸锂沉淀,反应的化学方程式为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;
(4)由表中数据可知:温度越高,锂元素浸出率越高;由此可知,用热水的原因是:碳酸锂在热水中溶解度很小,避免了洗涤过程中碳酸锂的损耗;可以验证洗涤后的溶液中含有碳酸根离子,不含硫酸根离子即可,方法为:取少量洗涤后的溶液于试管中,滴入足量稀盐酸,充分反应后滴入氯化钡溶液,若无明显现象,则已洗涤干净;
(5)①对比表中数据可知:2和3两组实验能说明温度对锂元素浸出率的影响;
②根据上表数据可知:其他条件相同时,增大MgSO4的用量,锂元素的浸出率提高;
③其他条件相同时,MgSO4的用量越大,锂元素的浸出率提高,可知方法合理的是CD。


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:初中化学 来源: 题型:
【题目】如图是某同学设计的实验室制取二氧化碳的装置图。
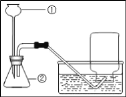
(1)指出图中仪器名称①_____;②_____。
(2)右图中有两处明显错误,请指出并改正①_____,②_____。改正错误后在发生装置内发生的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜和硫酸的混合溶液中硫元素的质量分数占3.2%,现将100g该混合溶液加入到氢氧化钠溶液中,恰好完全反应,测得消耗氢氧化钠溶液的质量为100g。下列说法不正确的是( )
A. 生成氢氧化铜沉淀的质量为9.8g
B. 氢氧化钠溶液中钠元素质量为4.6g
C. 所得溶液中溶质的质量为14.2g
D. 氢氧化钠溶液中溶质的质量分数为8%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组同学利用图1装置制备干燥的二氧化碳气体并探究其性质,实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
(1)组装好实验装置,加药品前应先进行的操作是______,装置A中甲的名称是______。装置B中盛装的试剂是______。
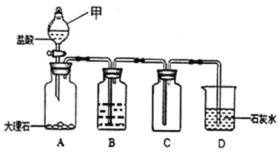
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
(查阅文献)碳酸盐与二氧化碳、水反应生成可溶于水的碳酸氢盐。
(提出假设)
假设1:挥发出的HCl使浑浊变澄清。反应的化学方程式是______。
假设2:碳酸钙与二氧化碳、水反应生成可溶于水的碳酸氢钙,从而浑浊变澄清。
(设计实验)为除去CO2中的HCl,小组同学在图1中增加图2装置,装置2中盛装的试剂是______(填选项序号)。
A.浓硫酸 B.NaOH溶液
C.饱和Na2CO3溶液 D.饱和 NaHCO3溶液
(实验现象)饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清。
(得出结论)由以上探究可得出结论______。
(3)该兴趣小组在老师指导下,用PH传感器测得图1烧杯中溶液的PH随通入二氧化碳的变化曲线如图
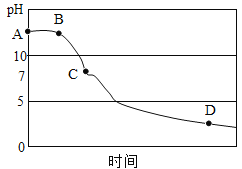
BC段产生的现象是______。参加反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“宏观——微观——符号”是化学独特的表示物质及其变化的方法,物质由分子、原子或离子构成
(1)下列物质由分子构成的是_____。
A 铜 B 水 C 氯化钠 D 乙醇
(2)下图是某反应过程的微观示意图,其中●和○分别表示两种不同的原子

①请在上方的虚线框中画上适当的粒子图形,以完善这个反应过程的微观示意图_____。
②写出一个符合上述微观示意图的化学方程式_____
(3)往硫酸钠溶液中滴加适量氯化钡溶液至恰好完全反应,实验时可以观察到的现象是_____,如图表示该反应前后溶液中存在的主要离子,则反应后溶液中含有的粒子有_____(填粒子符号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E均为初中化学常见的物质,它们的转化关系如图所示,部分生成物及反应条件已略去.
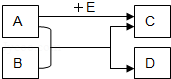
(1)如果A、B均为黑色固体,C是造成温室效应的主要气体,则E的化学式是 ,A与B反应的化学方程式可能是 .
(2)如果C是一种浅绿色溶液,D是红色固体单质,则E的化学式是 ,A与B反应的化学方程式可能是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图中的A~H表示几种初中化学常见的物质,分别是由H、C、O、Al、S、Cu中的一种或几种元素组成的。其中B、C、D、E、F均属于单质,G、H属于氧化物。B具有很好的抗腐蚀性能;D是最清洁的燃料;G有毒。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
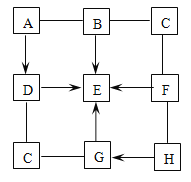
(1)D的名称是_____________。
(2)C的化学式为______________。
(3)写出B→E反应的化学方程式________________。
(4)写出F与H反应的化学方程式________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲酸(HCOOH)是一种有机酸,它的酸性比碳酸强,比盐酸弱,有刺激性气味和较强的腐蚀性.蚂蚁、蚊虫叮咬时会分泌出甲酸,所以甲酸又俗称蚁酸.
(1)人被蚊虫叮咬后会痒痛,可以涂抹下列物质中的(填序号)______消除.
①稀盐酸 ②食醋 ③肥皂水 ④食盐水
(2)白蚂蚁除了会蛀蚀木头以外,它分泌的蚁酸还会腐蚀很多建筑材料,下列建筑材料不容易被蚁酸腐蚀的是(填字母)______.
A 铜栏杆 B 钢筋 C 大理石 D 玻璃
(3)使用浓硫酸作催化剂,在加热的条件下,甲酸分解得到一种常见的有毒气体和另一种氧化物,其化学方程式为______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
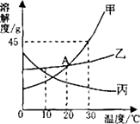
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com