
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
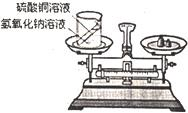 24、在学习了质量守恒定律后,小明和小华来到实验室,他们用右图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的.
24、在学习了质量守恒定律后,小明和小华来到实验室,他们用右图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的.| 阳离子\阴离子 | SO42- | N03- | PO43- | Cl- | C032- |
| Cu2+ | 溶 | 溶 | 不 | 溶 | 不 |
| 实验过程 | 实验现象 | 结论 |
向氢氧化钠溶液中滴加盐酸(或稀硫酸) |
有气泡产生 |
变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
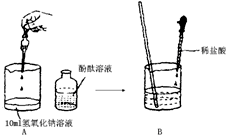 (2008?杨浦区二模)小王和小张两位同学对实验探究有一定的心得,以下是他们探究盐酸和氢氧化钠溶液的实录,请你参与探究并完成相关的问题:
(2008?杨浦区二模)小王和小张两位同学对实验探究有一定的心得,以下是他们探究盐酸和氢氧化钠溶液的实录,请你参与探究并完成相关的问题: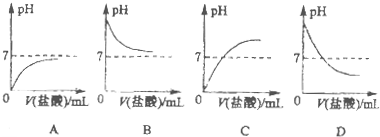
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验方案 | 使用的试剂 | 判断的方法 |
| A | 铁粉 | 如果有气泡产生,表明硫酸已经过量 |
| B | 碳酸钠粉末 | 如果有气泡产生,表明硫酸已经过量 |
| C | 紫色石蕊试剂 | 如果溶液变成红色,表明硫酸已经过量 |
| D | 硝酸钡溶液 | 如果有白色沉淀产生,表明硫酸已经过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com