
【题目】某同学对CaH2的制备和性质进行探究。
(阅读资料)①用H2与钙加热制得CaH2②钙遇水立即发生剧烈反应生成一种碱和一种气体
③CaH2要密封保存,遇水反应也生成一种碱和一种气体
(CaH2的制备)设计的制取装置如图所示.
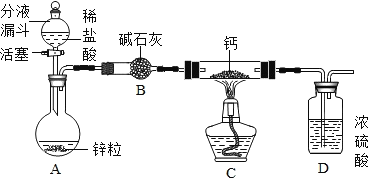
(1)装置D的作用是_____;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显_____色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是_____。
(CaH2的性质探究)取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH
猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3
猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因。________
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ______ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ______ | 猜想三成立 |
(定量分析)
(5)取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为______。
【答案】防止空气中水蒸汽进入 蓝 也可能是钙和水反应 H2 Na2CO3+Ca(OH)2= CaCO3↓+2NaOH 无明显现象 过一会儿有气泡产生 84%
【解析】
(1)装置D的浓硫酸具有吸水性,能防止空气中的水蒸气进入装置与钙发生反应,故填防止空气中水蒸气进入。
(2)CaH2遇水反应生成一种碱和一种气体,根据质量守恒定律,生成的碱为氢氧化钙,滴入石蕊试液后,能使石蕊溶液显蓝色,故填蓝;
钙遇水立即发生剧烈反应生成一种碱和一种气体,所以该反应也可能是钙和水反应,故填也可能是钙和水反应。
(3)生成的气体具有可燃性,根据质量守恒定律控制,该气体为氢气,氢气的化学式为H2,故填H2。
(4)Na2CO3与Ca(OH)2在同一溶液中会发生反应生成碳酸钙沉淀和氢氧化钠,所以两种物质在同一溶液中不能共存,故反应的化学方程式写为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
猜想二不成立,说明溶液中不含Ca(OH)2,所以加入少量 Na2CO3溶液后无明显现象,故填无明显现象;
猜想三成立,溶液中含有NaOH、Na2CO3,向其中加入足量稀盐酸,稀盐酸先与氢氧化钠反应生成氯化钠和水,当氢氧化钠完全反应后,稀盐酸再与碳酸钠反应反应生成氯化钠、水和二氧化碳,产生气泡,所以观察到的现象是过一会儿有气泡产生,故填过一会儿有气泡产生。
(5)解:2.4g碳酸钙中钙元素的质量为2.4g×![]() ×100=0.96g
×100=0.96g
CaH2样品中氢元素的质量为1g0.96g=0.04g
样品中CaH2的质量为0.04g÷![]() ×100%=0.84g
×100%=0.84g
所以样品中CaH2的质量分数为![]() ×100%=84%,故填84%。
×100%=84%,故填84%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。

①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用数字和化学符号填空:
(1)3个铝离子_____;(2)甲烷____;
(3)硫酸亚铁中铁元素的化合价为+2价_________;(4)碘酒中溶剂的化学式____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为探究铁合金中铁的质量分数,先后进行了四次实验(除铁外其它成分不与稀硫酸反应),实验数据如下表:根据该同学的实验,试回答以下问题:
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量∕g | 10 | 10 | 20 | 30 |
所加稀硫酸的质量∕g | 100 | 120 | 80 | X |
生成氢气的质量∕g | 0.2 | 0.2 | 0.2 | Y |
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X=__Y=__。
(2)该铜铁合金中铁的质量分数是多少__?
(3)所加稀硫酸溶质质量分数为多少______?(结果保留至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用如图装置完成 CO 还原 Fe2O3 的实验。缓慢通入一定量的 CO。点燃酒精喷灯,继续通入 CO。一段时间后,当粉末全部变为黑色时,停止通入 CO,熄灭酒精喷灯。

(1)CO 与 Fe2O3 反应的化学方程式是________。
(2)在冷却过程中,为防止管中黑色粉末表面因与空气接触而变为红色,应补充的操作是________。
(3)有同学提出黑色粉末中还可能含有 Fe3O4。资料: Fe3O4 不与 CuSO4 溶液反应。
为验证黑色粉末成分。该同学取少量样品于烧杯中,加过量 CuSO4 溶液,充分反应。证明黑色粉末中含 Fe 和 Fe3O4 的现象是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示。下列说法正确的是

A.物质W在水中的溶解度小于其在乙醇中的溶解度
B.t1℃时,m gW分别溶解在100 g水和乙醇中,两者都达到了饱和状态
C.t2℃时,物质W溶解在水中和乙醇中的溶质质量分数一定相等
D.将t1℃时物质W的饱和乙醇溶液升温至t2℃,溶质质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO45H2O),某课外活动小组的同学按如下流程进行实验:(反应中部分生成物已略去)
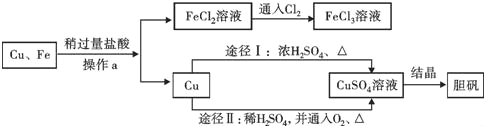
已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
回答下列有关问题:
(1)操作a的名称是 ;除去铜粉中的铁粉,最简便的实验方法是 。
(2)FeCl2溶液中通入Cl2发生化合反应,写出该反应的化学方程式 。
(3)由Cu制CuSO4溶液的途径Ⅱ中,若不通入O2,反应将不会发生,原因是 。途径Ⅱ与途径Ⅰ相比较,其显著的优点是 (回答一点即可)。
(4)FeCl3溶液可腐蚀铜以制作印刷线路板,反应后只生成两种常见的盐,则该反应的化学方程式 为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄金是贵重金属,性质稳定,应用广泛,有关金元素的说法正确的是( )
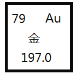
A.核电荷数为276B.原子序数为118
C.中子数为118D.相对原子质量为197.0g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com