
【题目】生石膏[化学式为CaSO4·2H2O]是一种用途广泛的工业材料和建筑材料。工业上用含SO2的烟气制备生石膏的简要流程图如下:
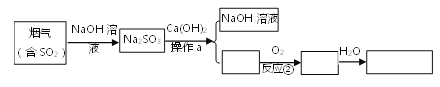
(1)在反应①时,常将NaOH溶液喷成雾状的原因是________。
(2)已知CaSO3不易溶于水,它属于________(填“酸”、“碱”、“盐”或“氧化物”),其中硫元素的化合价为______,反应②的化学方程式是_______。
(3)如果在实验室中进行分离操作a,所需的玻璃仪器有烧杯、玻璃棒和________。
(4)生产流程中生成的______可循环利用,节约成本。
【答案】 增大吸收面积,以加快反应速度 盐 +4 2CaSO3+O2=2CaSO4 漏斗 NaOH溶液
【解析】(1)在反应①时,常将NaOH溶液喷成雾状的原因是增大吸收面积,使反应物接触更充分,以加快反应速度,反应更彻底;(2) 由两种元素组成,且其中一种是氧的化合物叫氧化物。溶于水产生的阳离子只有氢离子的化合物是酸 。由金属或铵根和酸根组成的化合物叫盐,由金属或铵根和氢氧根组成的化合物叫碱。CaSO3属于盐,化合物中元素的化合价代数和为零,钙元素显+2价,氧元素显-2价,CaSO3中硫元素的化合价为+4,反应②的化学方程式是2CaSO3+O2=2CaSO4;(3)分离操作a是将难溶性固体与液体分离,操作是过滤,所需的玻璃仪器有烧杯、玻璃棒和漏斗;(4)生产流程中生成的NaOH溶液在反应物中存在,而且在后续的过程中又产生,可循环利用,节约成本。


科目:初中化学 来源: 题型:
【题目】以下是初中化学的一些基本实验,其中不能达到实验目的的是:
A. 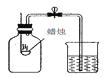 测定空气中O2的含量 B.
测定空气中O2的含量 B. 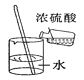 稀释浓硫酸
稀释浓硫酸
C. 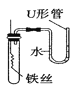 铁丝在空气中的变化 D.
铁丝在空气中的变化 D. 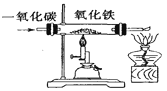 一氧化碳还原氧化铁
一氧化碳还原氧化铁
查看答案和解析>>
科目:初中化学 来源: 题型:
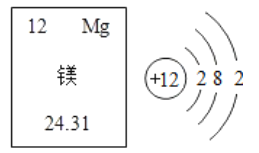
【题目】(1)镁元素的原子结构示意图及其在元素周期表中的信息如图所示。
①镁元素的原子序数是_____;
②镁原子核外有_____个电子层
③镁原子最外层有2个电子,在化学反应中易_____(填“得到”或“失去”)电子,形成离子,其符号为_____。
(2)现有A.碳酸氢钠B.氯化钠C.石墨D.二氧化碳,选择适当的物质填空(填标号)。
①绿色植物进行光合作用吸收的是_____;
②用于制铅笔芯的是_____;
③用于治疗胃酸过多症的是_____;
④用于消除公路上的积雪的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】红枣醋饮中含有一种酸[化学式为C4H6O5],具有美容养颜,解酒护肝健胃的重要用途。下列关于C4H6O5说法中正确的是
A. 由15个原子构成 B. 属于有机化合物
C. 氢元素的质量分数最大 D. 红枣醋饮是胃酸过多病人养胃首选饮料
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
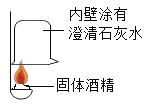
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生______________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组进行如下实验探究。

(1)验证物质的燃烧条件根据图1进行实验,实验现象如图所示。
①80℃热水的作用是_____。
②比较现象a、c,得出燃烧的条件是_____。
(2)验证锌与铁的金属活动性
①相同条件下,取等质量锌粉、铁粉,根据图2进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是_____。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是_____(填序号)。
A.左、右两边均有剩余 B.左边有剩余,右边无剩余
C.左、右两边均无剩余 D.左边无剩余,右边有剩余
(3)测定水中氢氧元素的质量比(已知H2+CuO△Cu+H2O)
根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。
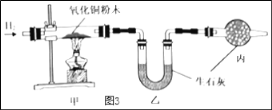
①水中氢、氧元素的质量比是_____(用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是_____(填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象不能正确反映对应变化关系的是( )
A.  向一定量的氧化铜粉末中逐渐加入稀硫酸至过量
向一定量的氧化铜粉末中逐渐加入稀硫酸至过量
B.  向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量
向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量
C. 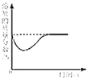 在饱和石灰水中加入少量生石灰
在饱和石灰水中加入少量生石灰
D. 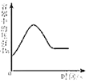 在密闭容器中用红磷测定空气中氧气的含量
在密闭容器中用红磷测定空气中氧气的含量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法错误的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
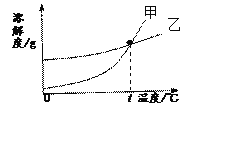
A. t℃在60℃到80℃之间,且甲表示KNO3的溶解度曲线
B. t℃时,甲、乙两种溶液的溶质质量分数不一定相等
C. 把60℃时的105g KNO3饱和液降温至20℃,能析出晶体78.4g
D. 两种饱和液从80℃降温到20℃,析出晶体的质量(不含结晶水)无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com