
【题目】近年,中美科学家合作从理论和实践上证实了全磷富勒烯B10的存在,成为烯实验和理论研究的新开端
(1薄膜状的全高勒烯具有重要应用前景。该材料属于_____________(填无机材料”或“合成材料”)
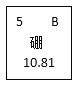
(2)在元素周期表中相关信息如图所示。下列说法正确的是______。
A 原子核内有5个质子
B 属于金属元素
C 的相对原子质量为10.81g
(3)单质可以通过镁矿Mg2B2O5来制取,制取过程的一步反应为加热条件下氧化硼与镁发生置换反应,得到单质和另一种氧化物,氧化硼和镁矿Mg2B2O5中硼元素的化合价相同。
①镁矿Mg2B2O5中硼元素的化合价为_________。
②氧化硼与镁发生置换反应的化学方程式为__________________________。
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:
【题目】下列图像不能正确反映对应变化关系的是

A.向等质量的氧化钙、氢氧化钙中分别加入等质量分数的稀盐酸至过量
B.向一定质量氯化亚铁和氯化铝的混合溶液中加入镁粉至过量
C.向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D.向等质量的镁、铝中分别加入等质量分数的稀硫酸至过童
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料在生产、生活中的应用非常广泛,根据所学知识完成相关内容。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的_____(填字母)。
A 导电性 B 导热性 C 延展性
(2)金属锈蚀造成浪费,铁制品锈蚀的过程,实际上是铁与空气中的氧气、水发生化学反应的过程,写出一种防锈措施_____。
(3)目前世界上己有50%以上的废钢铁得到回收利用,其意义有_____(填字母)。
A 节约金属资源 B 合理开采矿物 C 减少废金属对环境的污染
(4)等质量的X、Y两种金属粉末分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示。下列说法中不正确的是_____(填字母)。

A t1时,生成氢气的质量:X>Y B t2时,消耗金属的质量:X>Y
C t3时,消耗盐酸的质量:X=Y D t3时,消耗金属的质量:X=Y
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝热剂是把铝粉和氧化铁粉末按一定比例配成的混合物,用引燃剂持续燃烧放出的充足热量可引发铝粉与氧化铁粉末的反应,得到氧化铝和单质铁并放出大量的热。有关反应的化学方程式为2Al+Fe2O3 ![]() Al2O3+2Fe。下列有关该反应的说法不正确的是( )
Al2O3+2Fe。下列有关该反应的说法不正确的是( )
A. 基本反应类型为置换反应B. 反应物和生成物中元素化合价有0、+3、-2价三种
C. 体现出Fe2O3具有还原性D. Fe2O3中氧元素质量分数小于Al2O3中氧元素的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验创新是中学生最为重要的科学素养,某兴趣小组设计了如下图两套装置进行实验:
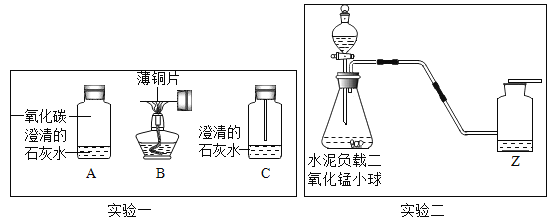
(1)为了加深对一氧化碳还原性的理解,婷婷同学设计了如图实验一所示的实验:
①将图B中灼烧后的薄铜片迅速插入到图A的装置中(如图C所示)。观察到图C装置中的薄铜片由黑色变成亮红色,其反应的化学方程式为___________________________________。
②实验室一般将剩余的一氧化碳气体导出点燃,其原因是_________________________________。
(2)实验二的装置可用于多次连续进行氧气的制取和性质的实验。其中水泥负载二氧化锰小球是指在水泥球表面粘附着一层二氧化锰粉末,便于实施固液分离。
①锥形瓶中制取氧气的化学方程式为______________,实验二中收集氧气的方法是____________。
②做氧气的性质实验时,实验不同,Z的作用不同:若Z为水,做细铁丝在瓶中燃烧时,水的主要作用是________________________;若为了验证蜡烛中含有碳元素,则Z应为____________________(填名称)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中常用锡纸包装食品、烧烤食品。市售的锡纸也称作铝箔、铝箔锡纸。某研究小组对锡纸中的金属到底是锡还是铝展开了如下探究。
查阅资料:在空气中锡和铝的表面会形成一层致密的氧化膜,从而对金属起到保护作用;四氯化碳不与金属、水反应,且不溶于水。
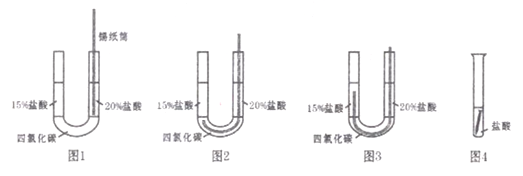
(实验1)如图1,在U形管内注人四氯化碳液体,从右侧注入5mL20%的盐酸,从左侧注入5mL15%的盐酸,然后将锡纸卷成圆筒状并伸入U形管右侧,观察到锡纸筒表面先有少
量气泡、稍后有大量气泡。此时,将锡紙筒推入四氯化碳层备用(如图2)。
(实验2)取一根粗细与锡纸筒一致的铁钉,用砂纸打磨后放入试管中,倒人5mL稀盐
酸(如图4),同时将U形管中的锡纸筒推入左侧盐酸中(如图3)。对比观察图3左侧和图4
的实验现象。
(实验结论)锡纸中的金属是铝。
(1)“实验1”中,U型管右侧盛装的20%盐酸的作用是________________________。
(2)当锡纸筒表面产生大量气泡时,才能把锡纸筒推入四氯化碳层备用的原因是________,产生大量气泡的化学方程式是_____________________________。
(3)图4试管中盐酸的质量分数应为__________________。
(4)研究小组的同学“对比观察图3左侧和图4的实验现象”,推断出“锡纸中的金属是铝”。你认为该现象是______________________,推断的理由是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】I.根据下列实验装置图,回答问题:
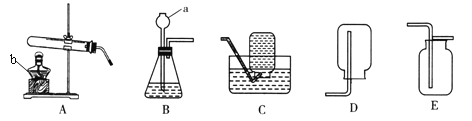
(1)实验仪器的名称:a_______________;b_________________。
(2)实验室用高锰酸钾制取氧气的化学方程式为:________________________________________,发生装置应该选用_______(填序号),该装置有一处不足,请改正:____________________________。要收集到较纯净的氧气,应该选用装置__________(填序号),若用该装置收集的氧气也不纯,原因可能是___________。
II.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体,能与稀硫酸反应:CuO+H2SO4═CuSO4+H2O
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1﹣1 | 1﹣2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1﹣2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2﹣2 | 1:10 | 混有很少量黑色物质 | |
2﹣3 | 1:11 | 混有极少量黑色物质 | |
2﹣4 | 1:12 | 无黑色物质 | |
2﹣5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)若碳还原氧化铜得到的固体全部是铜,请写出化学反应方程式______________________。
(2)实验1﹣2中,证明生成CO2的现象是_________________________________________。
(3)实验1的目的是____________________________________________________________。
(4)实验2的结论是______________________________________。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是________________________。
(6)如何检验2﹣4的红色固体中是否含Cu2O,请写出实验步骤、现象和结论 ________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以煤为原料获得的化工产品有着广泛的用途。请回答下列问题:
(1)煤是______(填“可再生”或“不可再生”)的化石能源。
(2)煤加工得到的焦炭广泛应用于炼铁。如图是高炉炼铁的示意图,据图回答:

①焦炭在炼铁过程中的主要作用是_____、_____;原料中石灰石的作用是______。
②铁矿石(主要成分为Fe2O3)进入高炉前要粉碎成小颗粒,其原因是____。写出高炉内生成铁的化学方程式:_______。
③图中出铁口低于出渣口,说明生铁的密度比炉渣_______(填“大”或“小”)。
(3)生铁的含碳量比钢_______(填“高”或“低”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。

已知:Sn+SnCl4=2SnCl2
(1)SnCl4中锡元素的化合价是_____________________。
(2)铜的金属活动性比锡的________(填“强”或“弱”),固体A中一定含有的金属元素是_______。
(3)写出步骤②发生反应的化学方程式________________________________________。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是__________________(回答一点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com