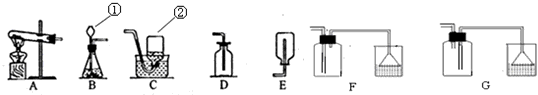鸡蛋是日常生活中常见的食品,某研究小组同学欲从化学的角度来进一步研究“鸡蛋”:
【实验探究一】同学们发现鸡蛋放置时间太久会变质并会产生一股臭味,这是什么原因呢?
查阅资料:
①鸡蛋久置后会变质产生硫化氢(H
2S)气体;硫化氢气体有剧毒,密度比空气大,能溶于水,溶于水后呈酸性.
②实验室可用硫化亚铁(化学式为FeS)固体和稀硫酸在常温下反应来制取硫化氢气体,同时生成硫酸亚铁;
同学们在实验室制取并收集了一瓶硫化氢气体,回答下列问题:
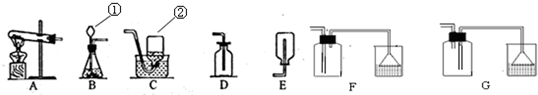
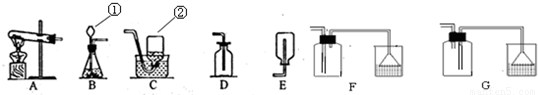
(1)写出有标号的仪器的名称
①
长颈漏斗
长颈漏斗
②
集气瓶
集气瓶
(2)H
2S气体中的硫元素的化合价为
-2
-2
,写出实验室制取硫化氢气体的化学方程式
FeS+H2SO4=FeSO4+H2S↑
FeS+H2SO4=FeSO4+H2S↑
,该反应属于
复分解
复分解
反应(填基本反应类型),制取该气体应选用的发生装置为
B
B
(填字母),收集硫化氢气体最好选用的装置为
F
F
(填字母),多余的气体可用
氢氧化钠
氢氧化钠
溶液来吸收.
【实验探究二】鸡蛋壳的成分
(注意:以下实验均假设鸡蛋壳中除碳酸钙以外的其他成分不能与酸反应,也不溶于水)
(3)小李同学查知鸡蛋壳的主要成份是碳酸钙,他用镊子取少许鸡蛋壳样品在酒精灯上灼烧,一开始闻到一股烧焦羽毛气味,说明内膜有
蛋白质
蛋白质
,继续灼烧后,看到蛋壳边变白,产生该白色物质的化学反应方程式为
,将充分灼烧后的蛋壳投入蒸馏水中,滴入无色酚酞试液,试液变为
红
红
色,发生反应的化学方程式为
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.
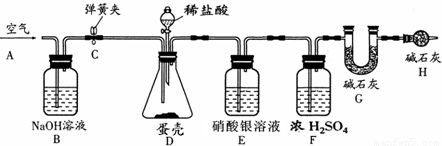
(4)为了进一步测定蛋壳中碳酸钙的质量分数,小刚同学进行了如下实验.
称量G装置质量为50.00g,按下图组装后,将10.00g蛋壳样品(已洗净、干燥并捣碎)放入锥形瓶中,加入足量稀盐酸,待锥形瓶中不再产生气泡时,打开弹簧夹C,从导管A处缓缓鼓入空气,一段时间后称量装置G质量为52.64g(不考虑原装置内空气对实验的影响).
回答下列问题:
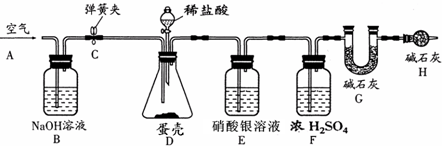
加入样品前还应
从导管A处缓缓鼓入空气
从导管A处缓缓鼓入空气
,装置D中反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
,装置E的作用是
吸收氯化氢气体
吸收氯化氢气体
,反应结束后打开弹簧夹C,缓缓鼓入空气的目的是
生成二氧化碳全部进入到G装置中
生成二氧化碳全部进入到G装置中
,装置B的作用是
吸收空气中二氧化碳
吸收空气中二氧化碳
,若缺少H装置,则测得的碳酸钙的质量分数将偏
大
大
.小刚的实验测得蛋壳中碳酸钙的质量分数为
60%
60%
.
(5)小勇同学重新设计了一种方案,将10.00g蛋壳样品(已洗净、干燥并捣碎)放在烧杯里,然后往烧杯中加入足量稀盐酸,蛋壳部分溶解,并产生大量气泡,实验过程和测定的相关实验数据如下所示:

小勇的实验测得蛋壳中碳酸钙的质量分数为
57%
57%
,小刚认为小勇的实验过程有一个明显的缺陷会导致测得的碳酸钙的含量偏低,这个缺陷是
未洗涤直接烘干就称量造成结果偏大,从而使得碳酸钙的含量偏低
未洗涤直接烘干就称量造成结果偏大,从而使得碳酸钙的含量偏低
.






 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案