
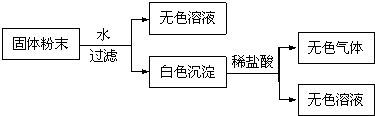


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+均呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中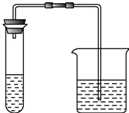 | 清的石灰水变浑浊 | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,先别滴加 后加 | 证明含有硫酸根离子 | |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO4-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈 | 证明含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
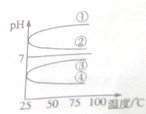 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com