
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+均呈蓝色 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、化学面对现代日益严重的环境问题显得无能为力 |
| B、实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |
| C、摩尔是七个基本物理量之一 |
| D、化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
- 4 |
2- 3 |
2- 3 |
A、NH
| ||||||
B、NH
| ||||||
C、Ca2+、I-、MnO
| ||||||
D、Ca2+、CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
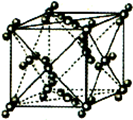 已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.
已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.43 |
| B、22.85 |
| C、80.01 |
| D、160.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
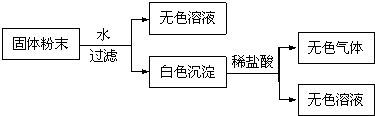
查看答案和解析>>
科目:高中化学 来源: 题型:
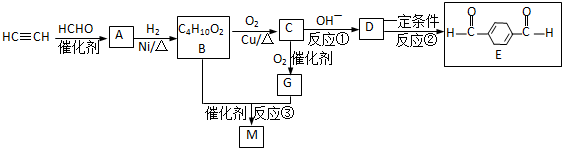
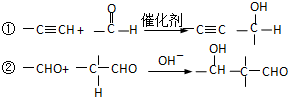
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③ |
| C、.①③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com