
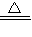 Br2+SO2↑+2H2O,为减少副反应发生,可先加水稀释,防止HBr被氧化;还能溶解溴化钠;减少HBr的挥发,但是不会分层;
Br2+SO2↑+2H2O,为减少副反应发生,可先加水稀释,防止HBr被氧化;还能溶解溴化钠;减少HBr的挥发,但是不会分层; C2H5Br+NaHSO4+H2O,
C2H5Br+NaHSO4+H2O, C2H5Br+NaHSO4+H2O
C2H5Br+NaHSO4+H2O

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
 蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr→Br2+SO2+2H2O
蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr→Br2+SO2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
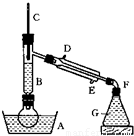
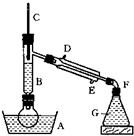 溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去).A-水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水.在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4.边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr=Br2+SO2+2H2O
溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去).A-水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水.在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4.边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr=Br2+SO2+2H2O| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
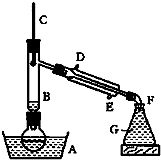
 溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去),其中G中盛蒸馏水.实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4.制备过程中边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.
溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去),其中G中盛蒸馏水.实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4.制备过程中边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com