
【题目】下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
【答案】D
【解析】
A.铁离子能够与![]() 发生络合反应;
发生络合反应;
B.根据电荷守恒判断,该离子方程式两边电荷不守恒;
C.该离子方程式不满足硫酸铁、氢氧化钡的化学组成关系;
D.根据![]() 计算出硫酸铁及铁离子的物质的量,再根据质量守恒及
计算出硫酸铁及铁离子的物质的量,再根据质量守恒及![]() 计算出铁的质量;
计算出铁的质量;
A.![]() 溶液中的
溶液中的![]() 与
与![]() 生成络合物,故在溶液中不能大量共存,故A错误;
生成络合物,故在溶液中不能大量共存,故A错误;
B.铁离子能够与碘离子发生氧化还原反应反应的离子方程式为:![]() ,题目方程式未配平,故B错误;
,题目方程式未配平,故B错误;
C.![]() 溶液和
溶液和![]() 溶液反应的生成氢氧化铁沉淀和硫酸钡沉淀,铁离子和
溶液反应的生成氢氧化铁沉淀和硫酸钡沉淀,铁离子和
硫酸根离子的物质的量的比为2:3。,正确的离子方程式为![]() ,故C错误;
,故C错误;
D.1 L 0.1 mol·L-1该溶液中含有溶质硫酸铁0.1mol,0.1mol硫酸铁中含有0.2mol铁离子,与足量锌反应可以生成0.2mol铁,生成铁的质量为11.2g,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
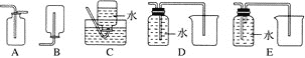
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)为了防止FeSO4溶液变质,应在溶液中加入少量的_________(元素符号表示)。
(2)人体血液中的下列物质不属于电解质的是_________(填序号,下同)。
a.H2CO3 b.葡萄糖(C6H12O6)
c.NaHCO3 d.NaCl
(3)区分Na2CO3和NaHCO3溶液可选用的方法或试剂是_________。
a.CaCl2溶液 b.焰色试验
c.Ca(OH)2溶液 d.NaOH溶液
(4)下列变化中,不涉及氧化还原反应的是_________。
a.金属的冶炼 b.钢铁的锈蚀
c.钟乳石的形成 d.食物的变质
(5)下列过程必须加入氧化剂才能实现的是_________。
a.Cl2→ClO- b.NH3→NH4+
c.KMnO4→MnO2 d.Fe2+→Fe3+
(6)质量相同的两份铝粉,分别放入足量的盐酸和NaOH溶液,放出的H2在同温同压下体积之比为__________________。
(7)明矾〔硫酸铝钾的结晶水合物:KAl(SO4)2·12H2O〕是一种常用添加剂,明矾在水中能电离出两种金属离子和酸根离子。写出硫酸铝钾电离方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是

A.Y电极反应为Pb+SO42--2e-=PbSO4
B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成
C.该电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁是橡胶制品的优良填充剂及补强剂,补强效果优于碳酸钙及陶土,其折射率与天然橡胶相近,适于制造透明或半透明制品。碱式碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
回答下列问题:
(1)碱式碳酸镁中各元素的第一电离能由大到小的顺序为 _______________,写出一种与CO32-互为等电子体的常见微粒_______________,原子序数与CO32-的价电子数之和相等的基态原子的价电子排布式为________。
(2)碱式碳酸镁晶体生长液中生长的3种生长基元的结构如图所示:
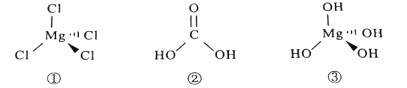
①(MgCl4)2-;②H2CO3;③[Mg(OH)4]2-
①和③中Mg原子的杂化方式为_______________,②中C原子的价电子对的几何分布形式为_______________。(MgCl4)2-中镁氯原子之间的距离R=0.25nm,则氯氯原子之间的距离为_______________(保留两位小数,已知![]() =2.45,cosl09°28'=
=2.45,cosl09°28'=![]() )。
)。
(3)碱式碳酸镁加热可分解生成MgO。已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构如图所示:

①请改正图中错误_______________(用文字表述)。
②在MgO晶体中,Mg2+的配位数为_______________,每个晶胞中所包含的Mg2+数目为_______________,每个Mg2+距离最近的且等距离的Mg2+数目为_______________。
③和某些离子化合物相比,MgO是一种优良的耐高温材料的内在原因为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是( )
A.向稀硝酸中加入过量铁:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
B.向FeCl2溶液中滴加碘水:2Fe2++I2=2Fe3++2I-
C.NaHCO3与Ca(OH)2按物质的量比1:2混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.已知酸性的强弱:H2CO3>HCN>HCO3-,则向NaCN溶液中通入少量的CO2时:2CN-+CO2+H2O=2HCN+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HClO的Ka=2.98×10-8,CH3COOH的Ka=1.75×10-5,下列有关说法正确的是
A.在![]() 的醋酸溶液中加入少量
的醋酸溶液中加入少量![]() 的稀盐酸,溶液的pH会变小
的稀盐酸,溶液的pH会变小
B.等浓度等体积的![]() 和NaClO溶液中离子总数,前者大于后者
和NaClO溶液中离子总数,前者大于后者
C.![]() 的新制氯水中:
的新制氯水中:![]()
D.由电离常数分析,![]() 溶液的pH一定比HClO溶液的pH小
溶液的pH一定比HClO溶液的pH小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜是一种附加值较高的铜类物质,下列流程是利用再生资源回收高品质氧化亚铜。某兴趣小组通过查阅资料得知CuCI可溶于![]() 浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为
浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为![]() ,
,![]() 在酸性条件下可歧化为
在酸性条件下可歧化为![]() 和Cu。据此设计了如下实验方案。下列说法正确是( )
和Cu。据此设计了如下实验方案。下列说法正确是( )

A.生成CuCl的离子方程式为![]()
B.为确保![]() 完全沉淀,应向含铜废液中加入过量的NaCl
完全沉淀,应向含铜废液中加入过量的NaCl
C.检验制得的![]() 中是否含有CuCl,可用硝酸银和硝酸
中是否含有CuCl,可用硝酸银和硝酸
D.可直接向含铜废液中加入葡萄糖,在碱性条件下制得![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
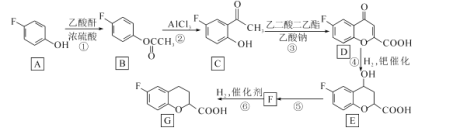
已知:乙酸酐的结构简式为![]() 。请回答下列问题:
。请回答下列问题:
(1)G中含氧官能团的名称是______________
(2)反应①的化学方程式为__________________
(3)反应⑤所需的试剂和条件是____,该反应类型是______________
(4)写出满足下列条件的C的同分异构体的结构简式________________________。
I.苯环上只有两种取代基;Ⅱ,核磁共振氢谱图中只有4组吸收峰;Ⅲ.能与NaHCO3溶液反应生成CO2。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则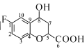 中的手性碳是____(填碳原子的数字标号)。
中的手性碳是____(填碳原子的数字标号)。
(6)设计以![]() 为原料制备
为原料制备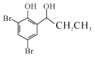 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com