
【题目】工业上常用天然气作为制备甲醇CH3OH的原料。已知:
①CH4(g)+O2(g)CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)CH3OH(g)△H=-90kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为______。
(2)向VL恒容密闭容器中充入a mol CO与2a molH2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强的关系如图所示:

①压强P1______P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为______(用含a,V的代数式表示)。
(3)甲醇燃料电池往往采用KOH(或NaOH)浓溶液作电解质溶液,电极采用多孔石墨棒,两个电极上分别通入甲醇和氧气。通入氧气的电极为:通入甲醇的电极上发生的电极反应为:______。用此燃料电池电解某浓度氯化钠溶液,电解一段时间后,收集到标准状况下氢气3.36L,此时燃料电池所消耗的CH3OH的质量为:______。
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中C(H2CO3)______C(CO32-)(填“<”、“>”或“=”)。
【答案】2CH4(g)+O2(g)2CH3OH(g)△H=-251.2KJ/mol < V2/a2 CH3OH-6e-+8OH-=CO32-+6H2O 1.6g >
【解析】
(1)依据热化学方程式和盖斯定律计算得到;
(2)①依据反应是气体体积减小的反应,铜温度下增大压强平衡正向进行;
②100°C时一氧化碳的转化率为50%,结合平衡三段式列式计算平衡浓度结合平衡常数概念计算得到;
(3)甲醇燃料电池中电解质溶液为KOH(或NaOH),燃料甲醇在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应;依据电子守恒分析计算消耗的CH3OH的质量;
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则HCO3-水解大于电离;
(1)![]()
![]()
![]() 依据盖斯定律
依据盖斯定律
① +②2×③得到:![]()
故答案为:![]() ;
;
(2)①图象分析可知相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2;
故答案为:<;
②向VL恒容密闭容器中充入amolCO与2amolH2,100℃时一氧化碳的转化率为50%,依据平衡三段式列式计算
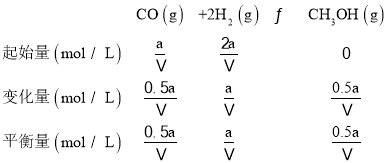
平衡常数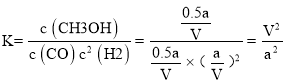 ,
,
故答案为:![]() ;
;
(3)甲醇燃料电池中电解质溶液为碱液,燃料甲醇在负极失电子发生氧化反应,电极反应为![]() ,正极上是氧气得到电子发生还原反应,电极反应为
,正极上是氧气得到电子发生还原反应,电极反应为![]() ;用该电池电解氯化钠溶液,当得到3.36L氢气物质的量为
;用该电池电解氯化钠溶液,当得到3.36L氢气物质的量为![]() 时,电极反应为
时,电极反应为![]() ,依据电子守恒可知,
,依据电子守恒可知,![]() ,燃料电池所消耗的CH3OH的质量为:
,燃料电池所消耗的CH3OH的质量为:![]() ;
;
故答案为:![]() ;1.6g;
;1.6g;
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则HCO3-水解大于电离,根据电离方程式和水解方程式![]() ,
,![]() ,可知c(H2CO3)>c(CO32-),
,可知c(H2CO3)>c(CO32-),
故答案为:>。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环![]() 上的一个H原子被一C4H9取代后的产物共有8种
上的一个H原子被一C4H9取代后的产物共有8种
C.对甲基苯乙烯中最多有17个原子共面
D.立方烷 一氯代物1种、二氯代物有3种、三氯代物也有3种
一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2(g)△H1
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是( )
A.Na2S的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.NaHCO3的电离:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C.HSO3-的电离:HSO3-![]() H++SO32-
H++SO32-
D.硫氢化钠溶液呈碱性:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6 (g)![]() C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
②H2 (g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
③ C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
则表征 C2H6 (g)燃烧热的热化学方程式为_____。
(2)1000℃时,在某刚性容器内充入一定量的 C2H6 ,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙 烷的平衡转化率为 40%。
①乙烷分解前容器压强为_____Pa ,1000℃时,反应①的平衡常数 Kp=_____Pa[气体分压(P 分)=气体 总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<” 或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
① 反应 C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
② 800℃时,控制原料气的总物质的量一定,当 C2H6 和 O2 的物质的量之比为 2:1 时,乙烯的平衡产率最大,而当![]() 较小时,乙烯的平衡产率较低,可能的原因为_____。
较小时,乙烯的平衡产率较低,可能的原因为_____。
(4)利用电解法可将 C2H6 转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成 HCOOH 的电极反 应式为_____。
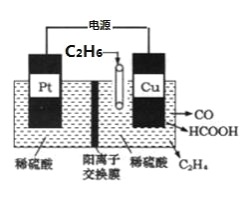
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组由Cu(NO3)2溶液先制得Cu(NO3)2·3H2O晶体,然后在下图所示实验装置中(夹持及控温装置省略),用Cu(NO3)2·3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知:SOCl2的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体。
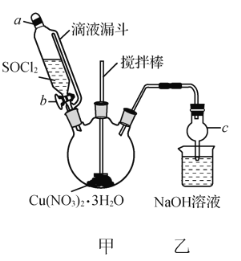
(1)由Cu(NO3)2溶液制得Cu(NO3)2·3H2O晶体的实验步骤包括蒸发浓缩、冷却结晶、抽滤等步骤。
①蒸发浓缩时当蒸发皿中出现______________________________(填现象)时,停止加热。
②为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是_______________(填一种)。
(2)①仪器c的名称是________。
②向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞________(填“a”或“b”或“a和b”)。
(3)装置甲中Cu(NO3)2·3H2O和SOCl2发生反应的化学方程式为__________________________________。
(4)装置乙的作用是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com