
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |

分析 (1)①已知:I.2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
Ⅱ.4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
根据盖斯定律,Ⅰ×2-Ⅱ可得:2NO(g)+Cl2(g)?2ClNO(g),焓变也进行相应计算,该反应平衡常数等于I的平衡常数平方与II的平衡常数的商;
②NO2-的水解常数Kh=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})×c({H}^{+})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})×c({H}^{+})}$=$\frac{Kw}{{K}_{a}(HN{O}_{2})}$,溶液中NO2-离子水解,溶液呈碱性,水也电离生成氢氧根离子;
(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol×$\frac{5.76}{4.8}$=0.36mol,由方程式可知2molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36-0.3)mol=0.12mol,再根据c=$\frac{△c}{△t}$计算0~4min内v(NO2);
8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol×$\frac{6}{4.8}$=0.375mol,再计算平衡时各组分的物质的量,根据K=$\frac{c(C{O}_{2})×c({N}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$计算平衡常数;
②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.
A.图中200℃时,反应没有到达平衡,向正反应进行;
B.b点反应向正反应进行,e点为较高温下平衡状态;
C.c、d温度不同,平衡常数不同;
D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡.
解答 解:(1)①已知:I.2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
Ⅱ.4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
根据盖斯定律,Ⅰ×2-Ⅱ可得:2NO(g)+Cl2(g)?2ClNO(g),该反应△=2△H1-△H2,平衡常数K3=$\frac{K_1^2}{K_2}$,
故答案为:2△H1-△H2;$\frac{K_1^2}{K_2}$;
②NO2-的水解常数Kh=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})×c({H}^{+})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})×c({H}^{+})}$=$\frac{Kw}{{K}_{a}(HN{O}_{2})}$=$\frac{1{0}^{-14}}{7.1×1{0}^{-4}}$=1.4×10-11,溶液中NO2-离子水解,溶液呈碱性,水也电离生成氢氧根离子,浓度顺序为:c(Na+ )>c(NO2-)>c(OH-)>c(HNO2),
故答案为:1.4×10-11;c(Na+ )>c(NO2-)>c(OH-)>c(HNO2);
(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol×$\frac{5.76}{4.8}$=0.36mol,由方程式可知1molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36-0.3)mol=0.12mol,0~4min内v(NO2)=$\frac{\frac{0.12mol}{3L}}{4min}$=0.01mol/(L•min);
8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol×$\frac{6}{4.8}$=0.375mol,设参加反应的均为为xmol,则:
CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)
起始量(mol):0.1 0.2 0 0 0
变化量(mol):x 2x x x 2x
平衡量(mol):0.1-x 0.2-2x x x 2x
所以0.1-x+0.2-2x+x+x+2x=0.375,解得x=0.075,
则平衡常数K=$\frac{c(C{O}_{2})×c({N}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$=$\frac{\frac{0.075}{3}×\frac{0.075}{3}×(\frac{0.15}{3})^{2}}{\frac{0.025}{3}×(\frac{0.05}{3})^{2}}$=0.675,
故答案为:0.01mol/(L•min);0.675;
②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.
A.图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故A正确;
B.b点反应向正反应进行,e处于平衡状态,且E温度高,故b点的v (逆)<e点的 v (逆),故B错误;
C.c、d温度不同,平衡常数不同,故C错误;
D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡,故D正确,
故选:AD.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、水解常数、反应热计算、浓度大小比较等,(2)中图象注意c、d点转化率相同,由于温度不同,平衡常数不相同.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂:
酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;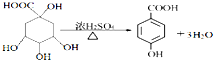 _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com