
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2∶1时,还原产物可能是
A.N2O B.NO C.NO2 D.N2
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2015河北保定某重点中学同步作业(必修1苏教版)1.2物质的分离与提纯 题型:填空题
下图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
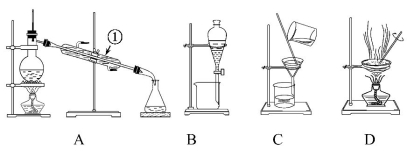
(1)从氯化钾溶液中得到氯化钾固体选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是 。装置B在分液时为使液体顺利滴下,应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
海

问题1:粗盐中含Ca2+、Mg2+、Fe3+、S 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是
。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是 (从给定的四种装置中选择)。
查看答案和解析>>
科目:高中化学 来源:2015河北保定某重点中学同步作业(必修1苏教版)1.2.2常见物质的检验 题型:选择题
某溶液中可能含有Cl-、 ,为了检验它们,正确的操作是 ( )
,为了检验它们,正确的操作是 ( )
A.先加BaCl2溶液(若有沉淀则滤去),再加AgNO3溶液
B.先加AgNO3溶液(若有沉淀则滤去),再加BaCl2溶液
C.先加Ba(NO3)2溶液(若有沉淀则滤去),再加AgNO3溶液
D.先加AgNO3溶液(若有沉淀则滤去),再加Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2015河北保定某重点中学同步作业(必修1苏教版)1.1物质的分类与转化 题型:选择题
盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是 ( )
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥ C.②⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省鞍山市高二下学期期末考试化学(B卷)试卷(解析版) 题型:填空题
(10分)许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同条件下发生的还原反应如下:
①酸性:MnO4-+5e-+8H+→Mn2++4H2O;
②中性:MnO4-+3e-+2H2O→MnO2+4OH-
③碱性:MnO4-+e-→MnO42-(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H++2e-→Mn2++2H2O
(1)MnO2与稀盐酸不能制取氯气,其原因是___________________________________。
(2)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是_______。(选填编号)
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(3)写出将SO2通入KMnO4溶液中所发生反应的离子方程式,并配平:
________________________________________________________________________。
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,已知产物中K2SO4和S的物质的量之比为3∶2。完成并配平该反应的化学方程式:
□KMnO4+□K2S+□__________→□K2MnO4+□K2SO4+□S↓+□__________,反应若生成5.44 g硫单质,反应过程中转移电子的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省鞍山市高二下学期期末考试化学(B卷)试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省鞍山市高二下学期期末考试化学(B卷)试卷(解析版) 题型:选择题
在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省鞍山市高二下学期期末考试化学(A卷)试卷(解析版) 题型:选择题
分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是
A.5种B.6种C.7种D.8种
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省抚顺市六校联合体高二下学期期末考试化学试卷(解析版) 题型:实验题
Ⅰ(本题9分)乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量。

| 乙酸乙酯 | 乙醇 | 乙酸 |
沸点 | 77.1℃ | 78.5℃ | 117.9℃ |
操作步骤如下:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/LNaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol/LNaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol/LHCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口装配相关的仪器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议
Ⅱ(本题6分)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。

(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50 mL溶液体积的容器是____________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将________(填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com