
| A、①③⑤ | B、③②⑥ |
| C、②④ | D、①④⑤ |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
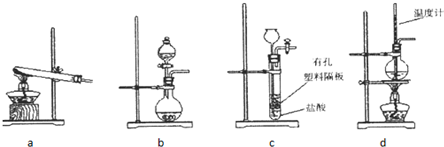
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )| A、a、c两点溶液的导电能力相同 |
| B、a、b、c三点溶液中水的电离程度:a>b=c |
| C、用等浓度的NaOH溶液分别与等体积的b、c两点溶液恰好完全反应,消耗NaOH溶液的体积相等 |
| D、b点溶液中存在微粒浓度关系:c(H+)=c(OH-)+c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z为四种短周期主族元素,其位置关系如图.
W、X、Y、Z为四种短周期主族元素,其位置关系如图. | W | X |
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
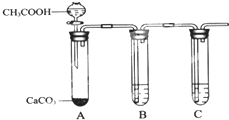
| A、锌和盐酸生成氢气 |
| B、亚硫酸钠和浓硫酸生成二氧化硫 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、氯化钠和浓硫酸生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、若其他条件不变,升高温度,则a>b |
| B、保持温度、压强不变,充入惰性气体,则有a=b |
| C、在该温度下,保持容积固定不变,向容器内补充A气体,则a>b |
| D、若a=b,则容器中的反应一定是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应.下列说法正确的是( )
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应.下列说法正确的是( )| A、其他条件不变,升高温度有利于PCl5的生成 |
| B、反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热△H=-798KJ?mol-1 |
| C、P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g)△H=-306KJ?mol-1 |
| D、PCl5分解为PCl3和Cl2的热化学方程式为PCl5(g)=PCl3(g)+Cl2(g)△H=-93KJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com