


科目:高中化学 来源: 题型:
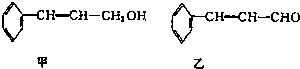
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl2褪色能在稀硫酸中水解 |
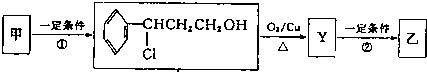
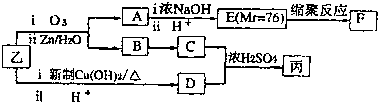
| ⅰO2 |
| ⅱZn/H2O |
| ⅰ浓NaOH |
| ⅱH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中可能存在Al3+ |
| B、溶液中可能存在Br- |
| C、溶液中一定存在CO32- |
| D、溶液可能存在Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
| 醋酸浓度(mol?L-1) | 0.0010 | 0.01000 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入氯化钡溶液,产生白色沉淀,过滤后向溶液中加入硝酸银溶液,有白色沉淀生成,则原溶液中一定有Cl-和SO42- |
| B、向某溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
| C、向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中不一定含有Cl- |
| D、向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液中一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、③②⑥ |
| C、②④ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 保存方法 | 理由 | |
| A | 浓硫酸 | 保存在密闭的细口瓶中 | 浓硫酸容易吸收空气中的水分 |
| B | 白磷 | 保存在水中 | 白磷在空气中易自燃 |
| C | 浓盐酸 | 保存在密闭的细口瓶中 | 浓盐酸易挥发 |
| D | 固体氢氧化钠 | 保存在带橡皮塞的细口瓶中 | 防止与空气接触氧化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com