
| A. | 新制氯水中只含有 Cl2和 H2O 分子 | |
| B. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| C. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
分析 氯气微溶于水,水中因溶解少量氯气而呈黄绿色,氯气与水反应:Cl2+H2O=H++Cl-+HClO,溶液呈酸性,加入AgNO3溶液,会有白色沉淀产生,HClO具有强氧化性、不稳定性和漂白性,加入有色布条,有色布条褪色.
解答 解:A.氯气微溶于水,氯气与水反应:Cl2+H2O=H++Cl-+HClO,新制氯水中含有Cl2、H2O和HClO等分子,故A错误;
B.氯气与水反应:Cl2+H2O=H++Cl-+HClO,加入AgNO3溶液,会有白色沉淀产生,故B错误;
C.HClO具有不稳定性,光照条件下分解生成氧气,故C错误;
D.HClO具有强氧化性和漂白性,加入有色布条,有色布条褪色,故D正确.
故选D.
点评 本题考查氯水的性质,题目难度不大,注意氯气、HClO的性质的理解应用,掌握基础是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{12b}{a}$或b•NA | B. | $\frac{12b}{a}$或a•NA | C. | $\frac{12a}{b}$或a•NA | D. | $\frac{12a}{b}$或b•NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水 阴极:Na++e-═Na | |
| B. | 电镀铜时(电解质溶液为CuSO4溶液) 阳极:Cu-2e-═Cu2+ | |
| C. | 电解熔融NaCl 阴极:Na++e-═Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如试管外壁有水,应在加热前擦拭干净 | |
| B. | 试管均匀受热,即先进行预热,然后把灯焰固定在放固体的部位加热 | |
| C. | 加热时不要使试管与灯心相接触 | |
| D. | 加热完毕,立即用冷水冲洗试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
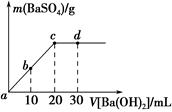 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com