
���� ��1����Ԫ�صĻ��ϼ۽��͵�����Ϊ����������Ԫ�ػ��ϼ����ߵ�����Ϊ��ԭ�������ݻ��ϼ۵ı仯����ת�Ƶĵ�������
��2��NaHCO3���ȶ��������ֽ⣬����̼���ơ�ˮ�Ͷ�����̼��
��3��Ư�۳���¶�ÿ�����ʱ���������ˮ��������̼��Ӧ����̼��ƺ�HClO��HClO�ֽ⣬�Ӷ����ʣ�
��4������������ˮ��Ӧ�ų������ȣ�ͬʱ����������
��� �⣺��1��2F2+2H2O=4HF+O2��OԪ�صĻ��ϼ���-2������0�ۣ�ʧȥ���ӣ���������ˮ����ԭ������Ӧ��F�Ļ��ϼ���0�۽��͵�-1�ۣ��õ��ӣ�����ԭ��F2������������Ӧ��ת�Ƶ�����Ϊ4��������Ӧ�е���ת�Ƶķ������ĿΪ��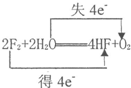 ��
��
�ʴ�Ϊ�� ��F2��H2O��
��F2��H2O��
��2��NaHCO3���ȶ��������ֽ⣬����̼���ơ�ˮ�Ͷ�����̼���䷴Ӧ�ķ���ʽΪ2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O��
�ʴ�Ϊ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O��
��3��Ư�۳���¶�ÿ�����ʱ���������ˮ��������̼��Ӧ����̼��ƺ�HClO��HClO�ֽ⣬�Ӷ����ʣ���������ʱ�����ķ�ӦΪCa��ClO��2+CO2=CaCO3+2HClO��2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2����
�ʴ�Ϊ��Ca��ClO��2+CO2=CaCO3+2HClO��2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2����
��4���ڰ��й������Ʒ�ĩ����֬���ϵμӼ���ˮ������������ˮ��Ӧ����������ͬʱ�ų������ȣ�ʹ�¶ȴﵽ��֬���Ż�㣬��֬��ȼ�գ�
�ʴ�Ϊ������������ˮ��Ӧ�����������ų������ȣ���Ӧ�ų�����ʹ��֬��ȼ�գ���Ӧ���ɵ�����ʹ��֬��ȼ�ռӾ磮
���� ���⿼��������ԭ��Ӧ��Ư�۵����ʣ����շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ�������������ԭ��Ӧ��������Ŀ��飬ע���Ԫ�ػ��ϼ۽Ƕȷ�������Ŀ�ѶȲ���


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ���ǹ��ʵ�λ����7������������֮һ | |
| B�� | ���ʵ����������ʵ����� | |
| C�� | ���ʵ�����һ�������������ʵ�����������Ⱥ�����������ӵ�������ϵ���� | |
| D�� | �DZ�ʾ���������ĵ�λ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ƿ�е�ԭ������ˮδ��ȥ | |
| B�� | �ܽ��õ��ձ�δ��ϴ�� | |
| C�� | ����ʱ�۲�Һ�温�� | |
| D�� | �ý�ͷ�ι�������ƿ��ˮʱ��ˮδ���̶���ֹͣ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/L NaHCO3��Һ������Ũ�ȹ�ϵ��C��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| B�� | 0.1mol/L NH4Cl��0.1mol/L NH3•H2O�������Ϻ�����Ũ�ȹ�ϵ��c��Cl-����c��NH4+����c��H+����c��OH-�� | |
| C�� | ����������Һ�еμ�ϡ����õ���pH=5�Ļ����Һ��c��Na+����c��NO3-�� | |
| D�� | �����£���pH=1����Һ�У�Fe2+��NO3-��ClO-��Na+�ܴ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 1 Lˮ���ܽ���58.5g NaCl������Һ�����ʵ���Ũ��Ϊ1mol•L-1 | |
| B�� | ��1 L 2mol•L-1��H2SO4��Һ��ȡ��0.5L��ʣ����Һ��Ũ����Ϊ2mol•L-1 | |
| C�� | �Ƴ�0.5L 10mol•L-1�����ᣬ���״�����Ȼ�������112L | |
| D�� | �к�100mL 1mol•L-1��H2SO4��Һ����NaOH������Ϊ4g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��ֻ���� Cl2�� H2O ���� | |
| B�� | ������ˮ�еμ���������Һ��û���κ����� | |
| C�� | ������ˮ�ڹ��յ������£����Բ������壬������������ | |
| D�� | ������ˮ��ʹ��ɫʯ����ֽ�ȱ�����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com