


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④⑦ |
| C、①②⑤⑥ | D、③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 固体物质中有FeCl3 | |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
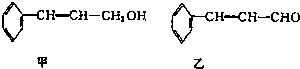
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl2褪色能在稀硫酸中水解 |
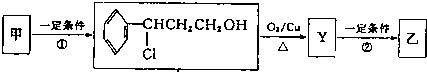
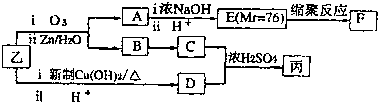
| ⅰO2 |
| ⅱZn/H2O |
| ⅰ浓NaOH |
| ⅱH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
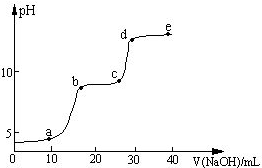 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na在Cl2中燃烧制NaCl |
| B、氯气溶于水制盐酸 |
| C、Cl2与石灰乳作用制漂白粉 |
| D、H2和Cl2混合光照制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入氯化钡溶液,产生白色沉淀,过滤后向溶液中加入硝酸银溶液,有白色沉淀生成,则原溶液中一定有Cl-和SO42- |
| B、向某溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
| C、向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中不一定含有Cl- |
| D、向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液中一定有Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com