
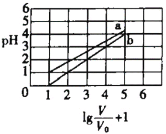
【题目】次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1molL-1的H3PO2溶液和1molL-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是
A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1![]() 10-2
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足![]()
【答案】C
【解析】
此题的横坐标是![]() ,V是加水稀释后酸溶液的体积,未稀释时,V=V0,横坐标值为1;稀释10倍时,V=10V0,横坐标值为2,以此类推。此题实际上考察的是稀释过程中,酸碱溶液pH的变化规律:越强的酸碱,稀释过程中pH的变化越明显;如果不考虑无限稀释的情况,对于强酸或强碱,每稀释十倍,pH变化1。根据此规律,再结合题干指出的次磷酸是弱酸这条信息,就可以明确图像中两条曲线的归属,并且可以得出氟硼酸是强酸这一信息。
,V是加水稀释后酸溶液的体积,未稀释时,V=V0,横坐标值为1;稀释10倍时,V=10V0,横坐标值为2,以此类推。此题实际上考察的是稀释过程中,酸碱溶液pH的变化规律:越强的酸碱,稀释过程中pH的变化越明显;如果不考虑无限稀释的情况,对于强酸或强碱,每稀释十倍,pH变化1。根据此规律,再结合题干指出的次磷酸是弱酸这条信息,就可以明确图像中两条曲线的归属,并且可以得出氟硼酸是强酸这一信息。
A.根据图像可知,b表示的酸每稀释十倍,pH值增加1,所以b为强酸的稀释曲线,又因为H3PO2为一元弱酸,所以b对应的酸只能是氟硼酸(HBF4),即氟硼酸为强酸;那么NaBF4即为强酸强碱盐,故溶液为中性,常温下pH=7,A项正确;
B.a曲线表示的是次磷酸的稀释曲线,由曲线上的点的坐标可知,1mol/L的次磷酸溶液的pH=1,即c(H+)=0.1mol/L;次磷酸电离方程式为:![]() ,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(
,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(![]() )=0.1mol/L,那么次磷酸的电离平衡常数即为:
)=0.1mol/L,那么次磷酸的电离平衡常数即为:![]() ,B项正确;
,B项正确;
C.次磷酸为一元弱酸,![]() 无法继续电离,溶液中并不含有
无法继续电离,溶液中并不含有![]() 和
和![]() 两类离子;此外,
两类离子;此外,![]() 还会发生水解产生次磷酸分子,所以上述等式错误,C项错误;
还会发生水解产生次磷酸分子,所以上述等式错误,C项错误;
D.令y=pH,x=![]() ,由图可知,在0≤pH≤4区间内,y=x-1,代入可得pH=
,由图可知,在0≤pH≤4区间内,y=x-1,代入可得pH=![]() ,D项正确;
,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:A
是一种有机烯醚,可以用烃A通过下列路线制得:A![]() B
B![]() C
C![]()
![]() 。则下列说法正确的是( )
。则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.A能使高锰酸钾酸性溶液褪色
D.①②③的反应类型分别为卤代、水解、消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同分异构体的有____,互为同素异形体的 有________,互为同位素的有________,是同一种物质的有________(填序号)。
(1)液氯 (2)氯气(3)白磷(4)红磷 (5)35Cl (6)37Cl
(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.将11.2LCl2通入足量的NaOH溶液中充分反应,转移的电子数为0.5NA
B.常温下,1.0LpH=1的H2SO4溶液中含有H+的数目为0. 2NA
C.4.4 g由CO2和N2O组成的混合气体中含有的电子总数为2.2NA
D.11.5 g乙醇分子中含有C-H键的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕,一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO)等一碳化合物在化工、医药、能源等方面都有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1mol HCHO过程中能量变化如图:
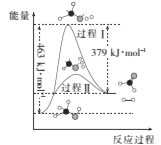
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.5kJ/mol
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) H=______kJ/mol
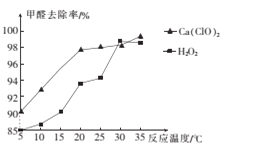
(2)氧化剂可处理甲醛污染,结合图象分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为____(填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) H=akJ/mol
①按![]() =2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
=2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
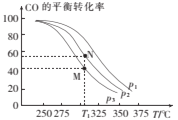
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol/L。达到平衡时,CO的转化率为图中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为______(保留3位有效数字)。
(4)工业上利用CH4(混有CO和H2)与水蒸气在一定条件下制取H2,该反应的逆反应速率表达式为v逆=kc(CO)c3(H2),k为速率常数,在某温度下测得实验数据如表所示:
CO浓度(mol/L) | H2浓度(mol/L) | 逆反应速率(mol·L-1·min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上述数据可得该温度下,c2=_____,该反应的逆反应速率常数k=____L3mol-3min-l。
(5)用甲醇可以制备甲胺(CH3NH2),甲胺在水中的电离方程式与氨相似。25℃时,甲胺的电离常数Ka=9.25×10-7。该温度下,反应CH3NH2+H+![]() CH3NH3+的平衡常数K= ___(填数值)。
CH3NH3+的平衡常数K= ___(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
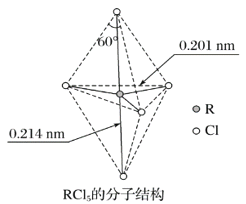
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体燃料电池技术处理 H2S废气并发电的原理如图所示 。根据不同固体电解质M因传导离子的不同,分为质子传导型和氧离子传导型,工作温度分别为 500℃和 850℃左右,传导质子时的产物硫表示为Sx。下列说法错误的是
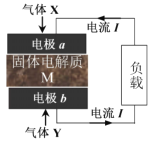
A.气体X 是H2S废气,气体Y 是空气
B.M传导质子时,负极a 反应为:xH2S—2xe-=Sx+2xH+
C.M传导氧离子时,存在产生SO2污染物的问题
D.氧离子迁移方向是从a 电极向b 电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
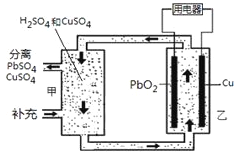
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com