
| 1 |
| 2 |


科目:高中化学 来源: 题型:
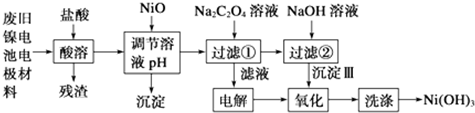
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①③⑥ |
| C、①③④⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .下列说法正确的是( )
.下列说法正确的是( )| A、橙花醛不能与Br2发生加成反应 |
| B、橙花醛能发生银镜反应 |
| C、1 mol橙花醛最多可以与2 mol H2发生加成反应 |
| D、橙花醛跟乙醛等是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①④⑤ |
| C、①②④⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取12.5g胆矾[CuSO4?5H2O]溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol?L-1 |
| B、取58.5gNaCl固体放入1L水中充分溶解,所得溶液中NaCl的物质的量浓度为1mol?L-1 |
| C、将100g 5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10% |
| D、将浓度为2 mol?L-1硫酸钠溶液10mL加水稀释至200mL,所得溶液浓度为0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
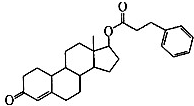 苯丙酸诺龙是一种兴奋剂,结构简式为:
苯丙酸诺龙是一种兴奋剂,结构简式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com