
| A、①③ | B、②④ | C、②⑤ | D、④⑤ |


科目:高中化学 来源: 题型:
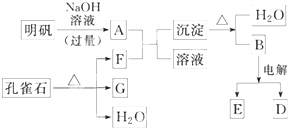 在一定条件下可实现如图所示物质之间的变化:
在一定条件下可实现如图所示物质之间的变化:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
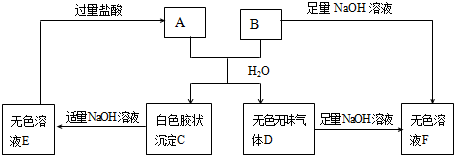
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通道 |
| B、明矾可以用来净水 |
| C、胶态金属氧化物分散于玻璃中制成有色玻璃 |
| D、三氯化铁溶液中加入NaOH溶液出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
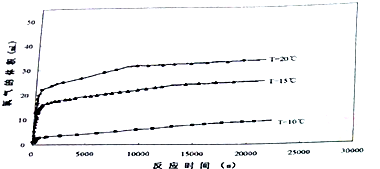 新型绿色硝化剂N205较传统硝化剂具有反应热效应小、温度容易控制、产物分离简单等优点,因而得到广泛的应用.
新型绿色硝化剂N205较传统硝化剂具有反应热效应小、温度容易控制、产物分离简单等优点,因而得到广泛的应用.| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol.L-1 | 4.00 | 3.52 | 2.00 | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com