
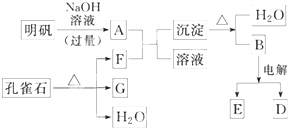
 在一定条件下可实现如图所示物质之间的变化:
在一定条件下可实现如图所示物质之间的变化:
| ||
| ||
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
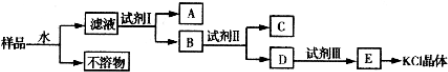
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
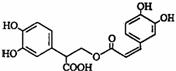 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图.下列叙述正确的是( )
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图.下列叙述正确的是( )| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和1mol氢气发生加成反应 |
| C、迷迭香酸可以发生水解反应但不能发生酯化反应 |
| D、迷迭香酸中只有一个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、②⑤ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com