
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
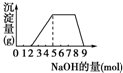 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:[已知:Mg2++2OH-═Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于水;NH4++OH-═NH3?H2O]由此可知,该溶液中肯定含有的离子是
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:[已知:Mg2++2OH-═Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于水;NH4++OH-═NH3?H2O]由此可知,该溶液中肯定含有的离子是查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、K2CO3 |
| 第三次 | Na2CO3、KCl、K2SO4、NaCl |
2- 4 |
2- 3 |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 | ||
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 | |||
| 第二步 | 继续滴加过量的 | 检验SO
| |||
| 第三步 | 过滤、再向滤液中滴加 | 检验 | Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com