


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
| A、原溶液一定不存在较大浓度的H+、Mg2+ |
| B、原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1 |
| C、不能确定原溶液是否含有K+、NO3- |
| D、实验中产生的棕色气体遇空气颜色会加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
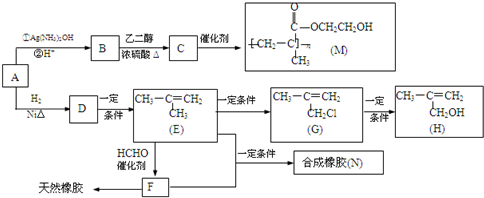
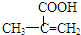 ,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式
,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
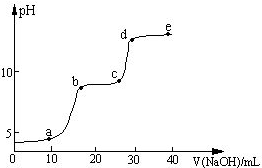 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作① |
| 加试剂A |
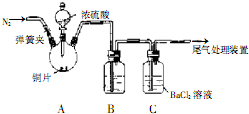
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、先加入KSCN溶液无明显现象,再加入氯水,溶液变血红色,一定有Fe2+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
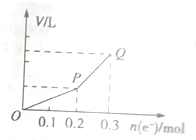 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.05molCu2(OH)2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com