
| A. | 加入HNO3酸化的Ba(NO3)2溶液 | |
| B. | 先加入HNO3酸化,再加Ba(NO3)2 | |
| C. | 加入盐酸酸化的BaCl2 | |
| D. | 先用盐酸酸化,若有沉淀,则过滤,滤液中再加BaCl2溶液 |
分析 检验某未知溶液中是否含有SO42-,应先加盐酸排除其它离子的干扰如碳酸根离子、亚硫酸根离子、银离子等的干扰,再加氯化钡,以此来解答.
解答 解:A.加入HNO3酸化了的Ba(NO3)2溶液,若为亚硫酸根离子也生成白色沉淀,不能检验,故A错误;
B.先加入HNO3酸化,若为亚硫酸根离子,亚硫酸根离子被硝酸氧化成硫酸根离子,再加Ba(NO3)2,生成白色沉淀硫酸钡,不能检验,故B错误;
C.先入HCl酸化了的BaCl2溶液,生成白色沉淀可能为AgCl,不能检验,故C错误;
D.检验某未知溶液中是否含有SO42-,应先加盐酸酸化,若有沉淀,则过滤,排除其它离子的干扰,再加氯化钡,生成白色沉淀可检验,故D正确;
故选D.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意检验离子的试剂及试剂的加入顺序,题目难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42- | |
| B. | 含有NaClO的溶液中:K+,Al3+,Br-,S2- | |
| C. | 澄清透明溶液:Cu2+、SO42-、HCO3-、H+ | |
| D. | 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑧ | B. | ①②③⑦ | C. | ③④⑤⑧ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
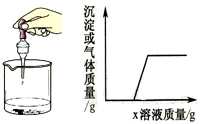 向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )| 序号 | 烧杯中的物质 | x溶液 |
| A | 生锈的铁钉 | 稀HCl |
| B | 盐酸与稀硫酸 | BaCl2溶液 |
| C | 镁铝合金 | NaOH溶液 |
| D | AlCl3和MgCl2溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| B. | 碳酸镁溶于硝酸中:2H++CO32-═CO2↑+H2O | |
| C. | 在澄清的石灰水中通入少量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 饱和氯化铁溶液滴入沸水中:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com