
分析 (1)根据NO的质量分数计算NO的质量,在根据n=$\frac{m}{M}$计算NO的物质的量,根V=nVm计算NO的体积;
(2)根据c=$\frac{1000ρw}{M}$计算碳酸钠溶液物质的量浓度;
(3)未被被吸收的NOx的质量为2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3;
(4)(i)根据n(NO):n(NO2)=9:1,结合1m3烟气中含有的二者质量计算烟气中n(NO)、n(NO2),令需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,利用吸收率最高时比例关系列方程计算;
(ii)发生反应NO+NO2+Na2CO3→2NaNO2+CO2、2NO2+Na2CO3→NaNO2+NaNO3+CO2,由方程式可知n(NaNO2)=2n(NO)+$\frac{1}{2}$[n(NO2)-n(NO)],再根据m=nM计算,注意吸收率为90%,实际质量为完全吸收的90%.
解答 解:(1)NO的最大质量为400mg×0.85=340mg,NO的体积为$\frac{0.34g}{30g/mol}$×22.4L/mol=0.25L,故答案为:0.25;
(2)该碳酸钠溶液物质的量浓度为$\frac{1000×1.16×0.15}{106}$mol/L=1.64mol/L,故答案为:1.64;
(3)未被被吸收的NOx的质量为2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3,故不符合,
故答案为:因通过Na2CO3溶液吸收后,吸收后烟气总体积减小,NOx含量仍超过400mg/m3;
(4)(i)由于n(NO):n(NO2)=9:1,则30×n(NO)+$\frac{1}{9}$n(NO)×46=2,解得n(NO)=0.057mol令需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,则(0.057-x):($\frac{1}{9}$×0.057+3x)=2:3,解得x=0.0176mol,故n(HNO3)=2x=0.035mol,
故答案为:0.035mol;
(ii)发生反应NO+NO2+Na2CO3→2NaNO2+CO2、2NO2+Na2CO3→NaNO2+NaNO3+CO2,由方程式可知n(NaNO2)=2n(NO)+$\frac{1}{2}$[n(NO2)-n(NO)]=$\frac{3}{2}$n(NO)+$\frac{1}{2}$n(NO2)=$\frac{3}{2}$×(0.057mol-0.0176mol)+$\frac{1}{2}$×($\frac{1}{9}$×0.057mol+3×0.0176mol)=0.0887mol,所以m(NaNO2)=0.0887mol×69g/mol×90%=5.5g,
故答案为:5.5g.
点评 本题考查物质的量浓度计算、物质含量的有关计算等,难度较大,(3)为易错点,容易忽略体积变化,(4)中的计算是难点,数据计算量较大,(ii)中注意根据方程式判断亚硝酸钠与二氧化氮、一氧化氮的物质的量关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
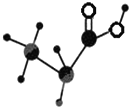 如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )| A. | 结构简式是C3H6O2 | B. | 不能和NaOH溶液反应 | ||
| C. | 官能团是羟基 | D. | 能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com