
| A. | S2-→HS- | B. | FeCl2→FeCl3 | C. | H2SO4→SO2 | D. | HNO3→N2O |
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取20.21mL质量分数为98%的浓H2SO4 | |
| B. | 将5.85g NaCl溶入100mL水中,制得1 mol/LNaCl溶液 | |
| C. | 将22.4LHCl气体溶于水配成1 L且浓度为1 mol/L的盐酸 | |
| D. | 将1体积cmol/L的硫酸用水稀释为5体积,以获得浓度为0.2cmol/L的硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | n=0.02 | |
| B. | y=2240 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度时,溶液的导电能力的强弱 | |
| B. | 在水溶液里电解质是否全部电离为离子 | |
| C. | 是离子化合物还是共价化合物 | |
| D. | 强电解质易溶于水,弱电解质难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M电极 | N电极 | 电解质溶液 | |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
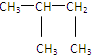 ⑩
⑩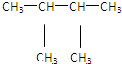 ⑪${\;}_{17}^{35}$Cl⑫
⑪${\;}_{17}^{35}$Cl⑫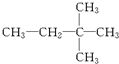
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com