
| A. | 相同浓度时,溶液的导电能力的强弱 | |
| B. | 在水溶液里电解质是否全部电离为离子 | |
| C. | 是离子化合物还是共价化合物 | |
| D. | 强电解质易溶于水,弱电解质难溶于水 |
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
 表示汞原子,
表示汞原子, 表示氧原子),下列说法错误的是( )
表示氧原子),下列说法错误的是( )
| A. | 氧化汞受热时能分解成汞和氧气 | |
| B. | 原子在化学变化中不能再分 | |
| C. | 氧化汞分子是由氧原子和汞原子构成的 | |
| D. | 所有物质都是由分子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 从石墨中分离出来的石墨烯是最薄、最坚硬、几乎透明的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法不正确的是( )
从石墨中分离出来的石墨烯是最薄、最坚硬、几乎透明的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法不正确的是( )| A. | 具有良好的导电性和透光性 | |
| B. | 石墨烯属于新型有机化合物,熔沸点较高 | |
| C. | 石墨烯、金刚石互为同素异形体 | |
| D. | 在氧气中燃烧可能生成CO2、CO或二者的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| Y | CO2 | FeCl3 | C2H5OH | Fe2O3 |
| W | MgO | CuCl2 | C2H5ONa | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碱性溶液中:Na+、NH4-、Cl-、NO3- | |
| B. | pH=4的无色溶液中:Na+、Ba2+、Cl-、SO32- | |
| C. | pH=10的无色溶液中:H+、NH4-、HCO3-、Cl- | |
| D. | 中性溶液中:K+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W03中W的化合价是+3价 | |
| B. | W03属于非金属氧化物 | |
| C. | 当消耗22.4L氢气时可以得到$\frac{1}{3}$ mol W | |
| D. | 当有1.8g水生成时,转移0.2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
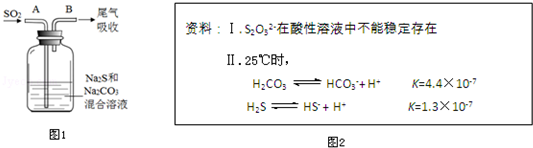
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com