
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
【答案】低温 3H2O―6e―=O3+6H+ n(O3):n(NO)<1时,NO被O3氧化为NO2所以增加;n(O3):n(NO)>1,NO2被转化为更高价的物质,所以减少(或NO2发生副反应,所以n(NO2)减少也给分) 该反应的活化能高,反应速率慢 BC 100 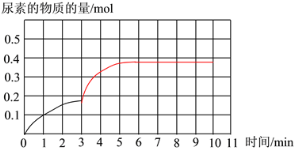
达到平衡时尿素的物质的量<0.5 mol,反应达到平衡的时间在10 min之前
【解析】
(1)SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g)反应为熵减的反应,熵减的反应在低温下有利于自发进行。
(2)用惰性电极电解稀硫酸,H+在阴极得电子发生还原反应,电极反应式为:2H++e-=H2↑;OH-在阳极失电子发生氧化反应,电极反应式为:3H2O―6e―=O3+6H+,则产生O3的电极反应式为:3H2O―6e―=O3+6H+。
(3)①n(O3):n(NO)<1时,NO被O3氧化为NO2,所以增加;n(O3):n(NO)>1,NO2被转化为更高价的氮氧化物,所以减少。
②臭氧的量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,若用过渡态理论解释可能是该反应的活化能高,反应速率慢。
(4)A.由左图可知相同时间内脱硫率大于脱硝率,则v(脱硫)>v(脱硝),故A错误;
B.由右图可知,随尿素溶液pH的增大,脱硫率的曲线没变化,但脱硝率曲线变化比较大,故尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响,故B正确;
C.如右图所示,pH越大脱除率越高,则强酸性条件下不利于尿素对氮氧化物的脱除,故C正确;
D.如右图所示,溶液的pH对脱硫率没有影响,故D错误。
(5)①NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)反应10 min后达到平衡,容器中气体密度为4.8 g·L-1,则容器中气体的质量为4.8 g·L-1×10L=48g,
2NH3(g) + CO2(g)CO(NH2)2(s)+H2O(g)
起始量(mol/L)0.2 0.1 0 0
变化量(mol/L)2x x x x
平衡量(mol/L)0.2-2x 0.1-x x x
则(0.2-2x)mol/L×10L×17g/mol+(0.1-x)mol/L×10L×44g/mol+xmol/L×10L×18g/mol=48, x=0.05,K=![]() 。
。
②通过①的分析可知,若温度不变,反应10 min后达到平衡,CO(NH2)2的物质的量为0.5mol。由于此反应为放热反应,升高温度,正逆反应速率均增大,达到平衡的时间小于10min,平衡向逆向移动,CO(NH2)2的物质的量为小于0.5mol。据此解答。
(1)SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g)反应为熵减的反应,熵减的反应在低温下有利于自发进行。本小题答案为:低温。
(2)用惰性电极电解稀硫酸,H+在阴极得电子发生还原反应,电极反应式为:2H++e-=H2↑;OH-在阳极失电子发生氧化反应,电极反应式为:3H2O―6e―=O3+6H+,则产生O3的电极反应式为:3H2O―6e―=O3+6H+/span>。本小题答案为:3H2O―6e―=O3+6H+。
(3)①n(O3):n(NO)<1时,NO被O3氧化为NO2所以增加;n(O3):n(NO)>1,NO2被转化为更高价的氮氧化物,所以减少。本小题答案为:n(O3):n(NO)<1时,NO被O3氧化为NO2所以增加;n(O3):n(NO)>1,NO2被转化为更高价的物质,所以减少。
②臭氧的量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,若用过渡态理论解释可能是该反应的活化能高,反应速率慢。本小题答案为:该反应的活化能高,反应速率慢。
(4)A.由左图可知相同时间内脱硫率大于脱硝率,则v(脱硫)>v(脱硝),故A错误;
B.由右图可知,随尿素溶液pH的增大,脱硫率的曲线没变化,但脱硝率曲线变化比较大,故尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响,故B正确;
C.如右图所示,pH越大脱除率越高,则强酸性条件下不利于尿素对氮氧化物的脱除,故C正确;
D.如右图所示,溶液的pH对脱硫率没有影响,故D错误。答案选BC。
(5)①NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)反应10 min后达到平衡,容器中气体密度为4.8 g·L-1,则容器中气体的质量为4.8 g·L-1×10L=48g,
2NH3(g) + CO2(g)CO(NH2)2(s)+H2O(g)
起始量(mol/L)0.2 0.1 0 0
变化量(mol/L)2x x x x
平衡量(mol/L)0.2-2x 0.1-x x x
则(0.2-2x)mol/L×10L×17g/mol+(0.1-x)mol/L×10L×44g/mol+xmol/L×10L×18g/mol=48, x=0.05,K=![]() 。本小题答案为:100。
。本小题答案为:100。
②通过①的分析可知,若温度不变,反应10 min后达到平衡,CO(NH2)2的物质的量为0.5mol。由于此反应为放热反应,升高温度,正逆反应速率均增大,达到平衡的时间小于10min,平衡向逆向移动,CO(NH2)2的物质的量为小于0.5mol,图像为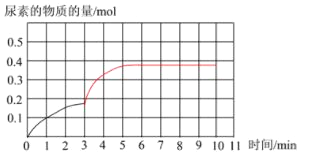 。本小题答案为:
。本小题答案为: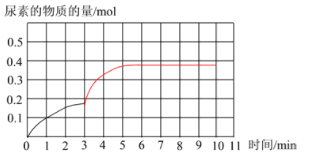 。
。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特利原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 增大压强,有利于SO2和O2反应生成SO3
C. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
D. 合成氨工业选择高温(合成氨反应为放热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
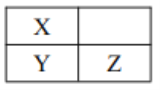
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是
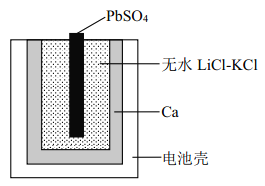
A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2NO(g)+O22NO2(g),在其他条件相同时,测得实验数据如图。请根据图示数据,下列有关该反应的说法正确的是( )

A. 相同条件下,化学反应速率随时间越来越快
B. 相同条件下,压强越大,化学反应速率越快
C. 相同条件下,温度越高,化学反应速率越快
D. 在0.1MPa、90℃条件下,反应20s时达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度为1.25 g·L-1,C能够发生银镜反应, E与B、D均能发生酯化反应。有关物质的转化关系如下:

请回答:
(1) F的结构简式______。
(2) A→B的反应类型______。
(3) C→D的化学方程式______。
(4) 下列说法不正确的是______。
A.将金属钠投入B中,金属钠沉入底部,并缓慢的放出气泡
B.2 mol F可以反应产生1 mol环状化合物,其分子式为C4H6O5
C.G加入NaHCO3溶液中会产生气体
D.1 mol H可以与含2 mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 以淀粉为原料可制取乙酸乙酯
B. 聚氯乙烯分子中含碳碳双键
C. 丁烷有3种同分异构体
D. 油脂的皂化反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (4c+12b-6a-5d) kJ·mol-1 B. (6a+5d-4c-12b) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1 D. (4c+5d-4a-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为__________,若将钠块放到石棉网上加热会生成______色固体,该反应的化学方程式为_______,该固体遇水会有无色无味的气体生成,该反应的化学方程式为___________,将氯气通入反应后的溶液中,发生反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com