
| A. | 二氧化硫体现还原性,做还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,据此分析.
解答 解:A.由反应方程式中二氧化硫S的化合价从+4价降低到+2价,则二氧化硫体现氧化性,做氧化剂,故A错误;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,每当4molSO2参与氧化还原反应就会放出1molCO2,则每10m3SO2参与反应就会放出2.5m3CO2,故D正确.
故选D.
点评 本题考查了氧化还原反应,注意根据反应物和生成物写出反应方程式,结合元素化合价的变化分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- | |
| B. | 无色透明的溶液中:Ba2+、H+、MnO4-、Br- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
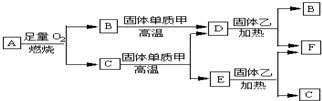
 以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NaOH═Na2SO3+H2O | |
| B. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | |
| C. | 2FeCl3+Fe═3FeCl2 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3、CuO→Cu(OH)2、CuSO4→CuCl2均不能通过一步反应实现 | |
| B. | FeS、FeCl2、Fe(OH)3均可以通过化合反应制得 | |
| C. | 水在化学反应中可能只做氧化剂、或只做还原剂、或既不做氧化剂也不做还原剂、或既做氧化剂又做还原剂 | |
| D. | 在某一复分解反应中,也有可能弱酸是反应物,而强酸是生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

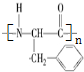 (写结构简式);
(写结构简式); ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com