
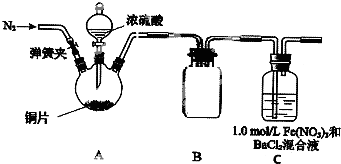
 某研究小组探究SO2和Fe(NO3),溶液的反应.
某研究小组探究SO2和Fe(NO3),溶液的反应.| m(FeCl2) |
| m(样品) |
| cmol/L×V2×10 -3L×5 |
| 1 |
| V |
| V 1 |
| CVV 2 |
| 200V 1 |
| ||
| mg |
| 127CVV 2 |
| 200V 1m |
| 127CVV 2 |
| 200V 1m |


科目:高中化学 来源: 题型:
| A、同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 |
| B、江河入海口,容易形成沙洲 |
| C、医学上治疗肾衰竭等疾病时,血液的净化手段利用血液透析 |
| D、向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B、向NaHSO4溶液逐滴滴加Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、醋酸和氨水混合:CH3COOH+OH-=CH3COO-+H2O |
| D、石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
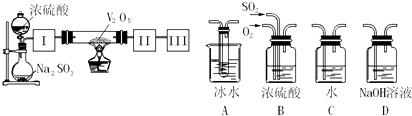
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有KNO3和Na2CO3,没有Ba(NO3)2 |
| B、肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| C、肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 |
| D、以上判断都不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com