
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
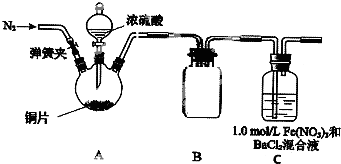 某研究小组探究SO2和Fe(NO3),溶液的反应.
某研究小组探究SO2和Fe(NO3),溶液的反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取5.68克Na2CO3固体 |
| B、用量筒量取30.26 ml液体 |
| C、向小试管中加入100 ml液体 |
| D、用胶头滴管取约1 ml液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| B、(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| C、(Ⅲ)的作用是吸收有毒的SO2气体 |
| D、(Ⅱ)所盛X应为品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、HCO3-、NO3- |
| B、Na+、SO42-、Cl-、ClO- |
| C、H+、Mg2+、SO42-、NO3- |
| D、Fe3+、NO3-、SCN-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?(CH3COO-) |
| c(CH3COOH) |
| A、当向该溶液中加入一定量的硫酸时,K值增大 |
| B、升高温度,K值增大 |
| C、向醋酸溶液中加水,K增大 |
| D、向醋酸溶液中加氢氧化钠,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有①② |
| C、只有②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L |
| B、0.5 mol/L |
| C、2 mol/L |
| D、1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com